OLABS ∨
解决方案 ∨
法规月报 2019年9月
1
行业概况
国务院发布关于加强和规范事中事后监管的指导意见 1807期
卫健委印发全民健康信息化为基层减负工作措施通知 1795期
科技部印发《国家新一代人工智能创新发展试验区建设工作指引》通知 1798期
浙江、河北、北京、福建、黑龙江、天津、广西先后发布《医疗器械注册人制度试点工作实施方案征求意见稿》1792期、 1796期、1802、1821期
发改委印发《关于支持建设博鳌乐城国际医疗旅游先行区实施方案》通知 1808期
国家药品监督管理局正式加入IMDRF国家监管机构报告信息交换机制 1813期
民政部印发《关于进一步扩大养老服务供给促进养老服务消费的实施意见》 1816期
国家医保局:国家组织药品集中采购和使用试点扩至全国 1817期
21部委印发《促进健康产业发展高质量行动纲要(2019-2022年)》 1821期
2
监管动态
法规文件
重点法规节选:
2019年9月5日,国家药监局关于印发医疗器械检验工作规范的通知
2019年9月10日,国家药监局关于深圳莱福百泰医疗科技有限公司2个产品不予注册的公告(2019年 第75号)
2019年9月10日,国家药品监督管理局医疗器械标准管理中心关于印发医疗器械标准化工作档案管理要求的通知
2019年9月17日,国家药监局综合司公开征求《关于做好第一批实施医疗器械唯一标识工作有关事项的通告(征求意见稿)》意见
2019年9月20日,国家药监局关于发布国家医疗器械监督抽检结果的通告(第6号)
表 1 2019年1~9月法规文件发布
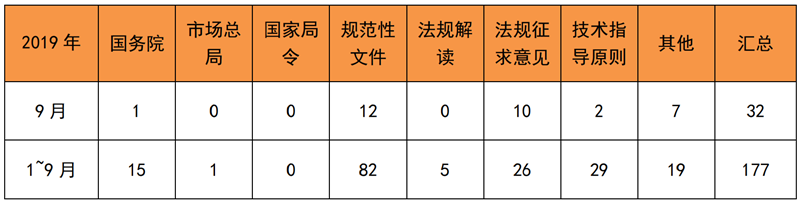
来源:相关部门官网,奥咨达整理。
九月中旬,国务院发布《国务院关于加强和规范事中事后监管的指导意见》,要求对医疗器械等重点产品建立以产品编码管理为手段的追溯体系。可见,监管越来越科学,要求企业的合规水平就越来越高。随后,国家药监局发布《关于做好第一批实施医疗器械唯一标识工作有关事项的通告(征求意见稿)》,挑选部分高风险医疗器械作为第一批实施品种。对此,进入试点的械企走在了行业的前列,建立科学的医疗器械追溯体系,已成为当务之急。
技术规范
技术指导原则:
2019年9月,国家局共发布了2项技术指导原则,器审中心则公开征求3D打印髋臼杯等9个产品的技术指导原则:
表 2 2019年9月发布的技术指导原则
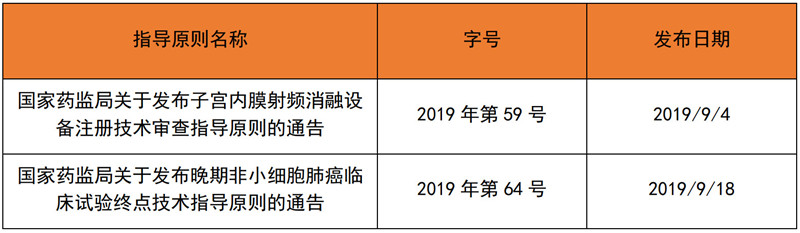
来源:NMPA官网,奥咨达整理。
2019年1~9月,国家局共发布技术指导原则29项,去年同期则为49个,同比减少40.82%。
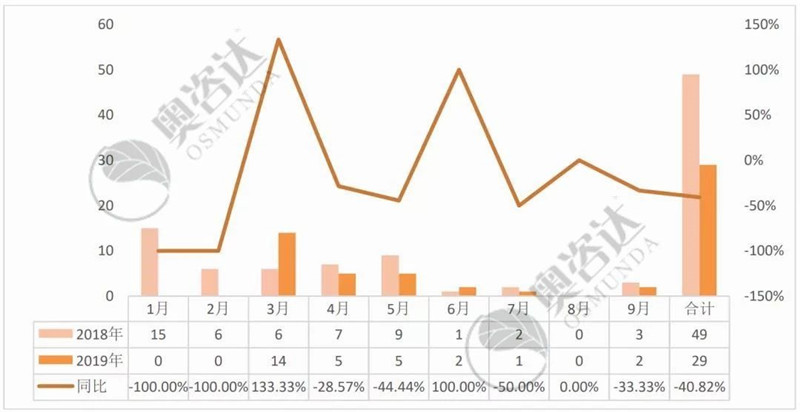
图 1 2019年较2018年同比情况
来源:NMPA官网,奥咨达整理。
3
注册审批
审批情况
2019年9月,国家局共批准医疗器械注册证941张,较上月环比增加53%。
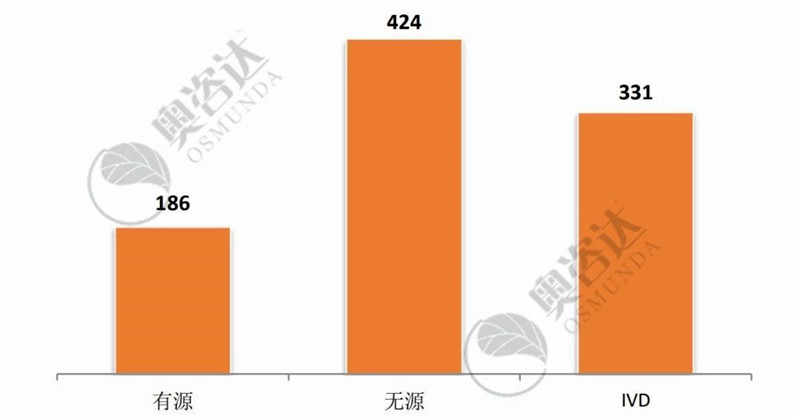
图 2 2019年9月注册证-产品种类
来源:CMDE官网,奥咨达整理。
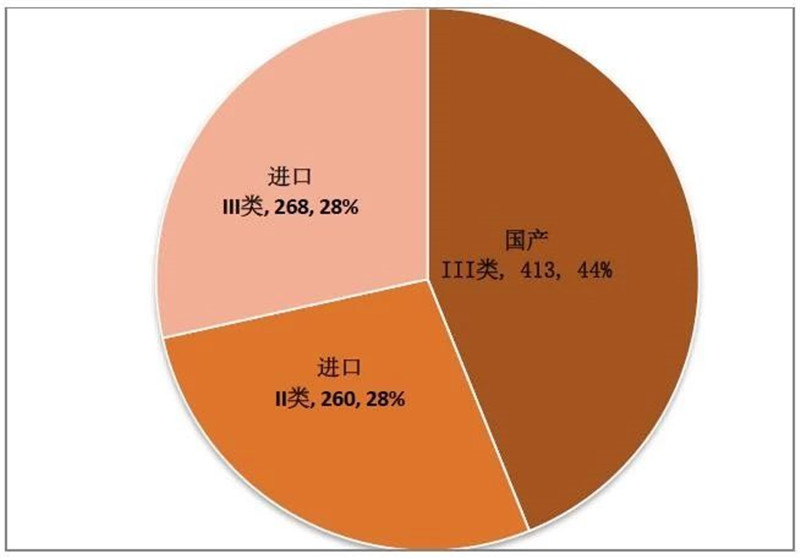
图 3 2019年9月注册证-国产/进口
来源:CMDE官网,奥咨达整理。
2019年1~9月,国家局共批准6431张注册证。
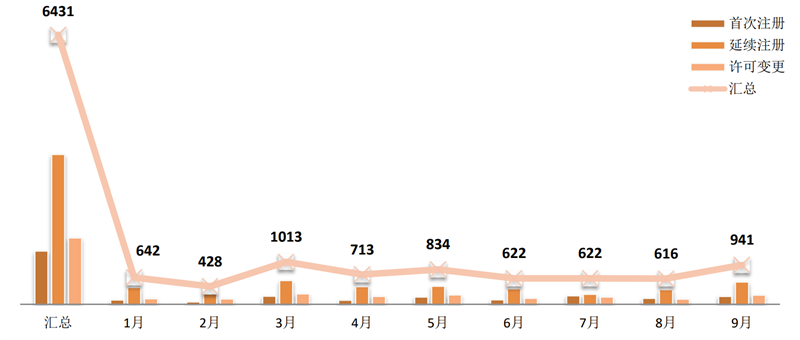
图 4 2019年1~9月医疗器械注册类型
来源:CMDE官网,奥咨达整理。
与2018年同期相比,国产注册数量大幅上升,其中9月的增长最为显著、接近去年的2倍。具体来看,主要得益于国产IVD的爆发增长,今年前9个月的注册数量是去年同期的176.45%。
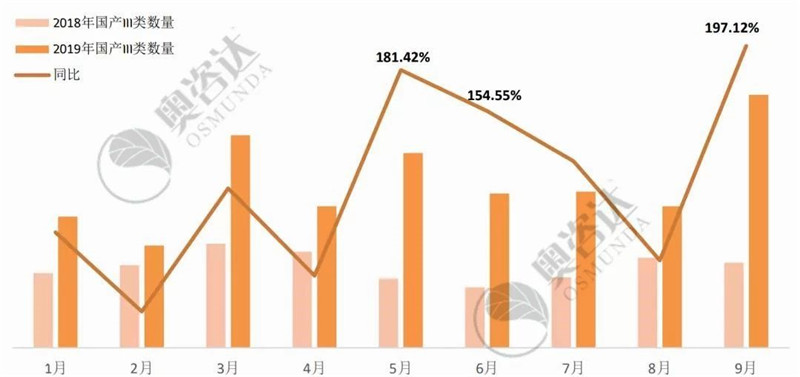
图 5 2019年较2018年注册类型同比情况
来源:CMDE官网,奥咨达整理。
如以首次注册来看,今年1~8月国家局批准的注册证为1078个。其中,有源299个、无源480个、体外诊断试剂299个;国产646张,进口432张。
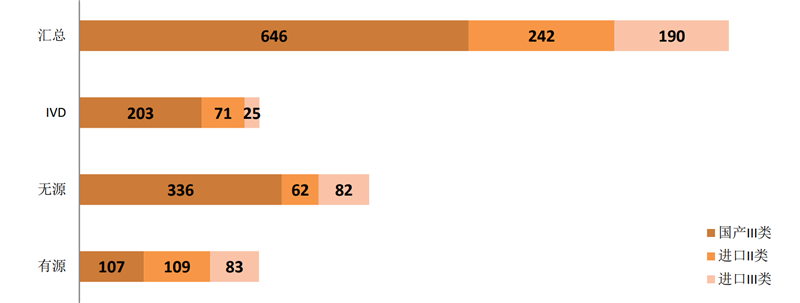
图 6 2019年1~8月首次注册情况
来源:NMPA官网,奥咨达整理。
从国产企业所在省市来看,江苏和北京继续领跑第一集团,并逐渐拉大与第二集团的距离。进口产品,则美国企业优势明显,稳居各国取得注册证数量之首。
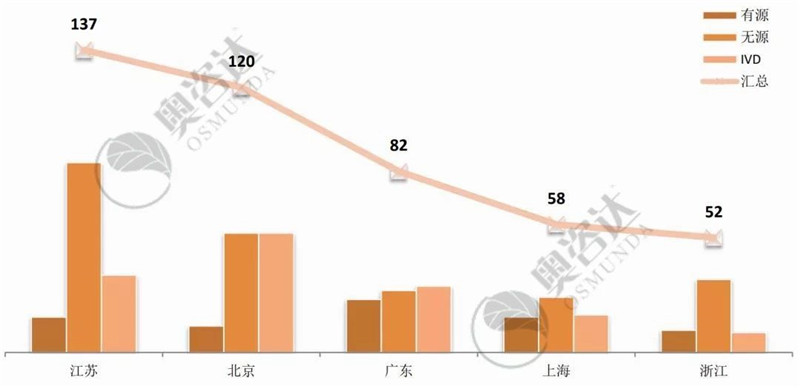
图 7 2019年1~8月国产首次注册数量-前五省市
来源:NMPA官网,奥咨达整理。
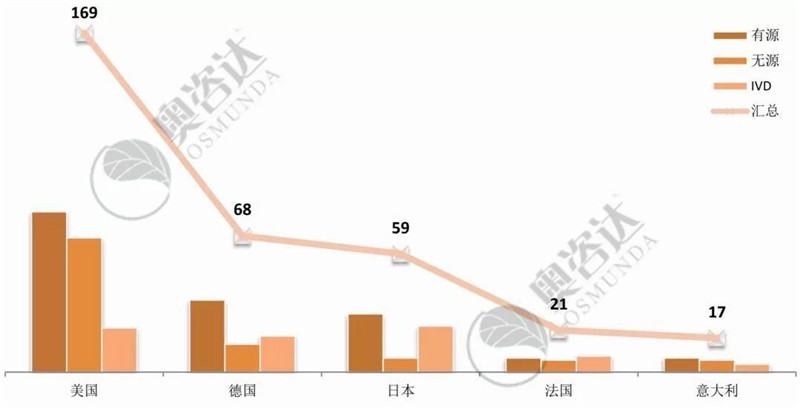
图 8 2019年1~8月进口首次注册-国家分布
来源:NMPA官网,奥咨达整理。
产品退审情况
9月18日,国家药监局发布关于深圳莱福百泰医疗科技有限公司2个产品不予注册的公告:有证据表明,申请人提供虚假资料申请产品注册。根据《条例》相关规定,样品真实性不符合要求,不予注册相关产品。涉嫌犯罪的,及时移交司法机关处理。
2014-2016年的大面积退审、2017年造假入刑、2018年条例修订处罚到人,重典治乱、落实最严监管,监管部门已经发出强烈信号。医疗器械企业必须确保注册申请资料的真实、准确、完整、可追溯!
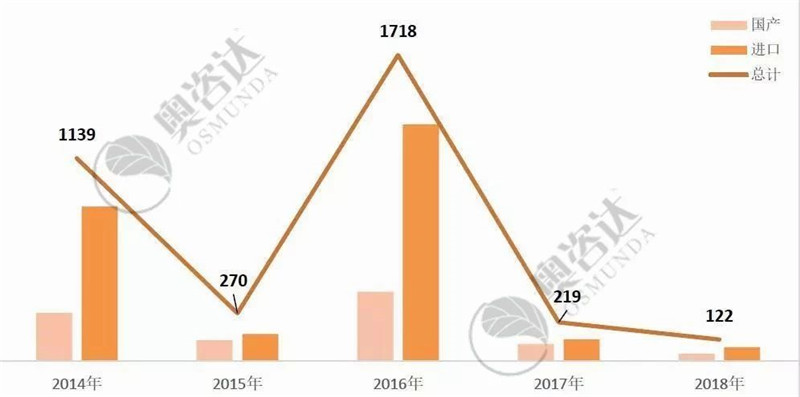
图 9 2014年至2018年不予注册情况
来源:CMDE官网,奥咨达整理。
今年1-9月,国产三类或进口医疗器械共退审286个,其中不予注册有113个,自行撤审144个,自行撤销注册证29个,具体情况如下:
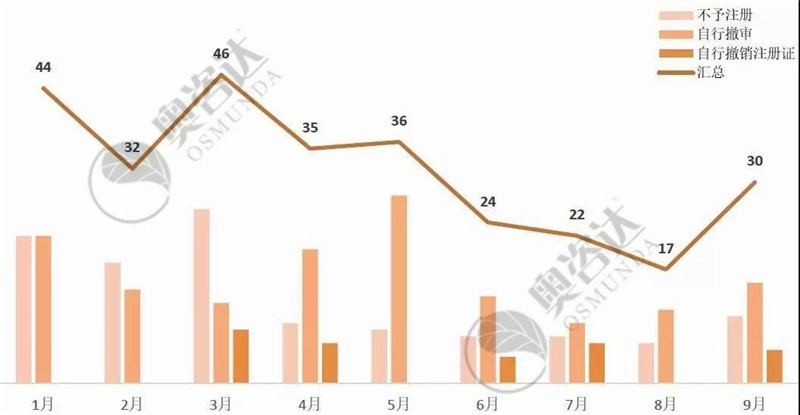
图 10 2019年1~9月退审情况
来源:NMPA官网,奥咨达整理。
国家局不予注册的产品具体情况如图 11,以首次注册为主。其中,国产III类的占比最大、约为40%;而无源产品,占退审总数的近五成。
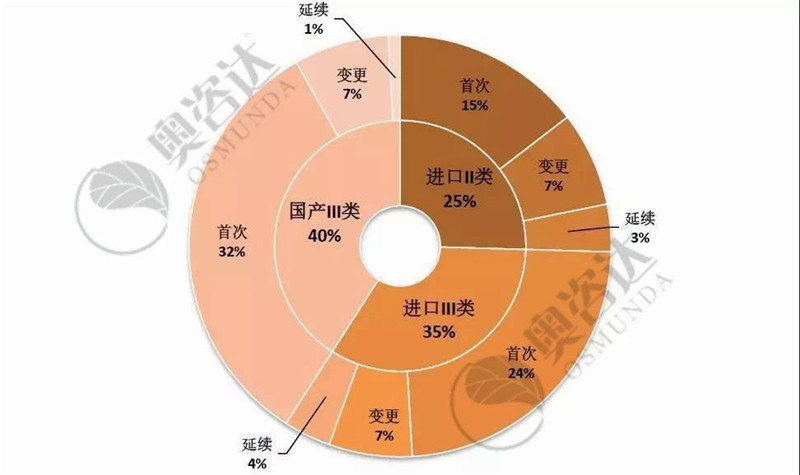
图 11 2019年1~9月不予注册情况
来源:CMDE官网,奥咨达整理。
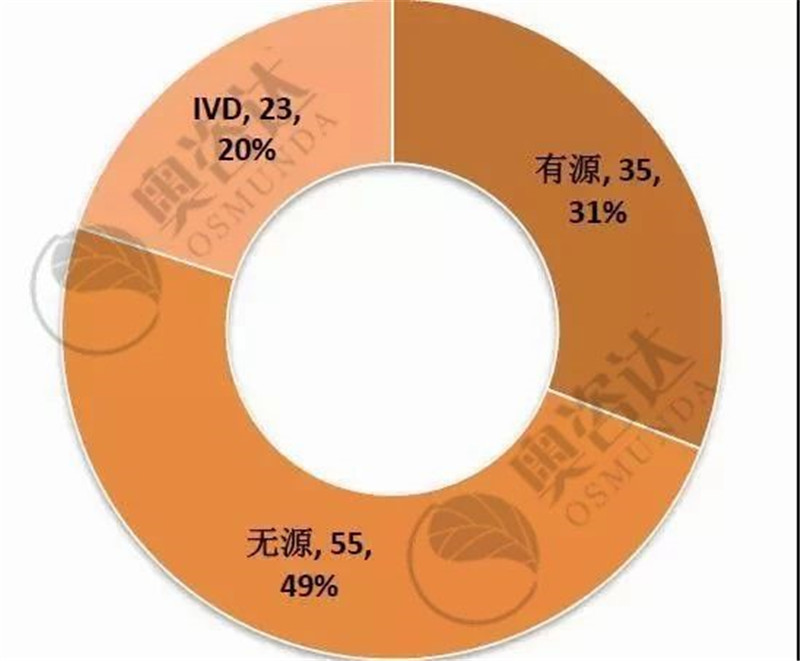
图 12 2019年1~9月不予注册情况—产品类别
来源:CMDE官网,奥咨达整理。
随着注册人制度的试行和推进,今年监管部门不断发布各类医疗器械全生命周期的监管法规和要求,企业主体责任意识不断加强。自2017年以来,企业自主撤审的比例,从2016年14.23%,猛增至60%以上!
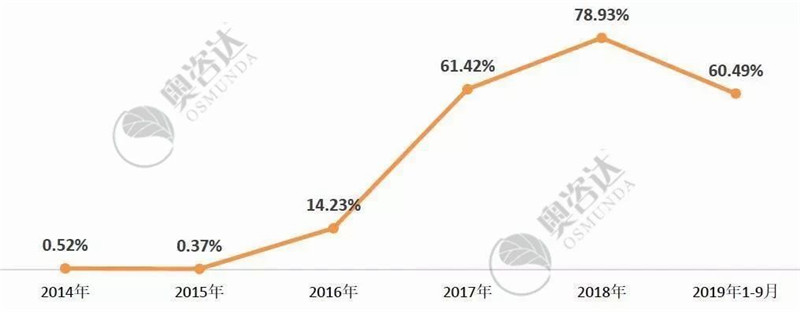
图 13 2014年以来企业自主撤审比例
来源:NMPA和CMDE官网,奥咨达整理。
4
创新&优先
创新情况
2019年1~9月创新医疗器械公示数一共为30个,今年9月的创新产品公示有2个。
表 3 2019年9月创新公示产品清单
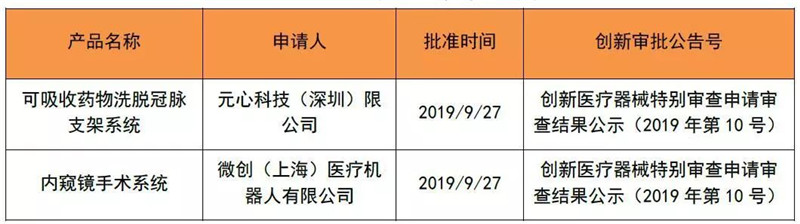
来源:CMDE官网,奥咨达整理。
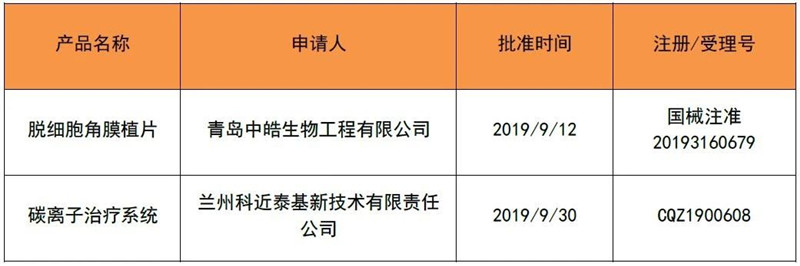
2019年9月,有2个创新产品取得注册证,情况如表4。今年1~9月,国家局共批准了12个创新产品上市。
表 4 2019年9月创新取证产品清单
来源:CMDE官网,奥咨达整理。
2014年至今,共236个产品进入国家创新通道,73个创新产品取得医疗器械注册证。
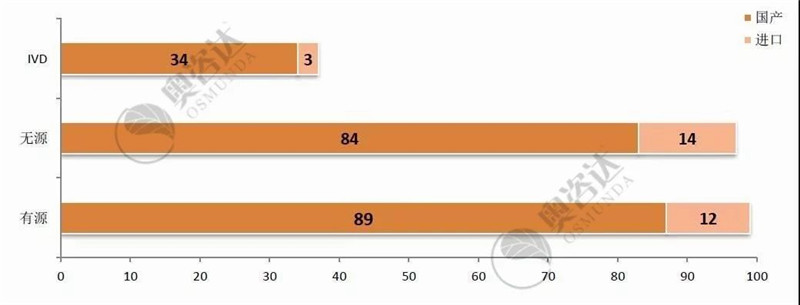
图 14 2014年至今创新产品公示情况
来源:CMDE官网,奥咨达整理。
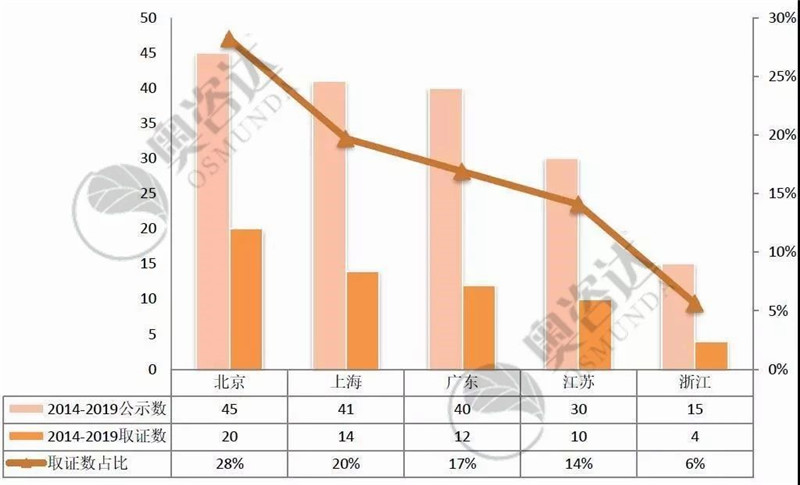
图 15 2014年至今创新产品取证情况(国内-前五)
来源:CMDE官网,奥咨达整理。
从图 15可见,北京市不愧是科技创新之都,无论是创新医疗器械公示还是取证数双双高居全国第一,获批上市的创新医疗器械占全国总数的28%。
优先情况
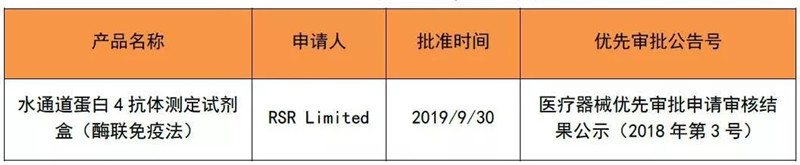
2019年9月,有1个优先审批的产品取得注册证,如下表。今年1~9月,国家局共批准了6个优先审批的医疗器械上市。
表 5 2019年9月优先取证产品清单
来源:CMDE官网,奥咨达整理。
2019年1~9月,共有12个产品获得国家局的优先审批,如图 16。
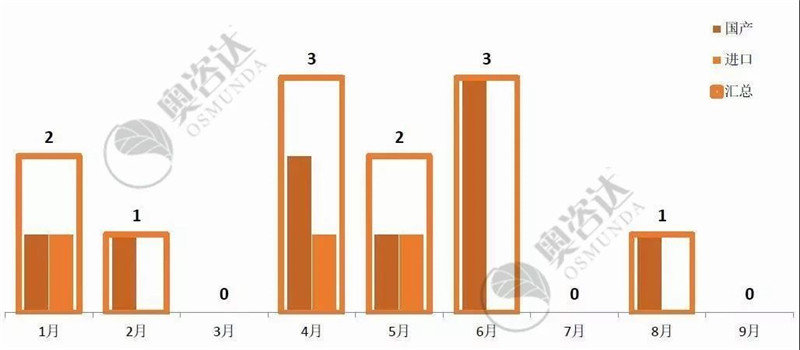
图 16 2019年优先公示月度情况
来源:CMDE官网,奥咨达整理。
2017-2019年共有32个产品进入优先审批通道。如今已有13个产品获批上市,其中国产产品取证为10个,进口产品取证为3个。
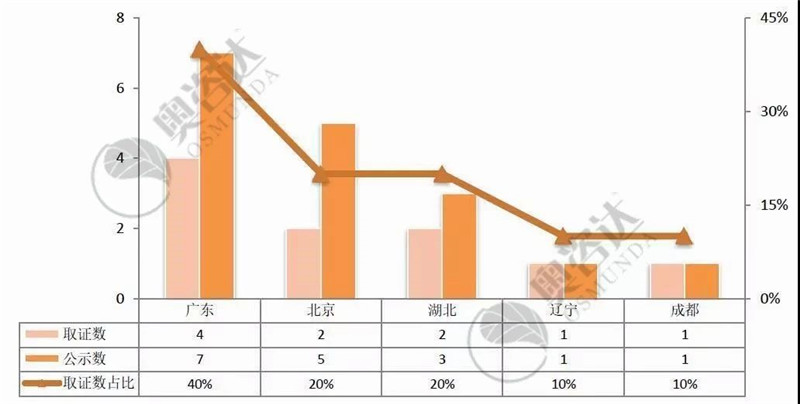
图 17 2017年至今优先产品取证情况(国内-前五)
来源:CMDE官网,奥咨达整理。
从图 17可知,广东省在全国的优先审批医疗器械产品上,遥遥优秀,占全国三类产品优先审批的40%。
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632