OLABS ∨
解决方案 ∨
“狂犬疫苗”、“造假”与“救命药”、“我不是药神”形成两大关键词并行线索在近日持续发酵,已然成为公众事件。
7月15日,国家药品监管机构在对长春长生生物科技有限责任公司开展飞行检查中,发现该企业冻干人用狂犬病疫苗生产存在记录造假等严重违反《药品生产质量管理规范》行为,对此责令吉林食药监局收回该企业《药品GMP证书》,并责令狂犬疫苗停产。目前,吉林省食品药品监督管理局调查组已进驻该企业,对相关违法违规行为立案调查。国家药品监督管理局派出专项督查组,赴吉林督办调查处置工作。
通告一经公布,便引起了巨大的舆论效应,特别是去年长春长生生物因疫苗出现问题已被国家药监局点名批评,但显然并没有吸取教训并进行整改。虽然已声明所有涉事批次产品尚未出厂和上市销售,全部产品已得到有效控制,但对于事关生命安全的事情,造假及其安全性问题引发了全国性的关注与愤慨。

药品、疫苗、医疗器械事关民生发展,从近年来飞检的“出手”频度与力度中也能看出,国家对于医疗产业监管加强势在必行。就医疗器械领域来说,据今年4月国家食品药品监督管理局发布的《2017年度食品药品监管统计年报》统计,2017年食品药品监管部门查处医疗器械案件1.7万件,货值金额1.8亿元,罚款金额4.3亿元,没收违法所得金额1969.1万元,取缔无证经营161户,捣毁制假售假窝点31个,责令停产停业98户,吊销许可证13件,移交司法机关62件。
为配合不断加强的监管力度,国家药监局在人手调配上也加大马力。2018年6月28日,国家药监局发布通知,为进一步加强药品检查员队伍和能力建设,推进药品生产企业现场检查工作开展,对检查员队伍进行了扩充,新聘任145人为国家药品GMP检查员并核发《国家药品检查员证》。随着检查员队伍的进一步扩充,开展生产企业现场检查的力度和频次也在随之增强。
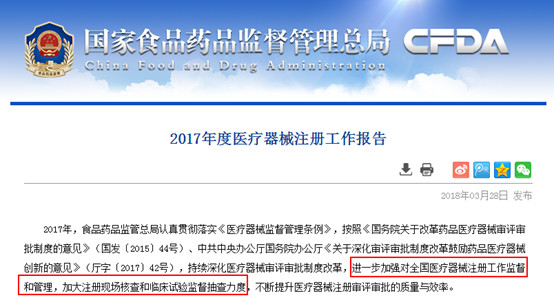
另一方面,我国医疗器械企业基数大、分布广。据《2017年度食品药品监管统计年报》统计,截至2017年11月底,全国实有医疗器械生产企业1.6万家,其中,可生产一类产品的企业6096家,可生产二类产品的企业9340家,可生产三类产品的企业2189家;全国共有二、三类医疗器械经营企业41.0万家,其中,仅经营二类医疗器械产品的企业22.5万家,仅经营三类医疗器械产品的企业6.1万家,同时从事二、三类医疗器械经营的企业12.4万家。面对如此庞大的医疗器械企业主体,即使从政策计划层面或是人员补充角度来看,我国医疗器械企业分布分散又繁多,监管机构难免处于一种疲于奔命的状态,易陷入“捉襟见肘”的局面,很难对市场进行全方位的有效监管。
随着医疗器械注册人制度在上海、广东、天津的试点推行,奥咨达创新性地在上海、广州、深圳三地筹建CDMO+CRO平台,通过共享厂区、设备、人员、体系等软硬件实施,实现医疗器械产业聚集。在未来2019~2020年时间中,还将布局天津、成都、武汉、江浙等地,拓展至全国,实现超过7家CDMO落地,真正实现我国医疗器械产业聚集,促进国家监管更加集中、便捷。
奥咨达作为第三方的服务机构,以往在CRO领域深耕多年,对法规与标准的严格管理深入奥咨达每一位员工的行为准则,恪守医疗器械研发、生产、注册、上市等全生命周期过程中的每一项法规细则与标准。
奥咨达CDMO平台的生产体系经过包括国家监管部门GMP在内的严格政府审查,项目管理、生产、流程优化、安全环保(EHS)和信息安全能力经过严格审计,保障客户委托生产及附加服务的合规合法,同时CDMO平台聚集大量医疗器械企业,形成产业化聚集,助力国家部门加强对医疗器械的监督管理,保障群众生命财产安全。
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632