OLABS ∨
解决方案 ∨

奥咨达:绝对实力+高效可靠的实施方案 1 ORIMS 医疗器械合规智造管理软件 将【人、机、料、法、环、测】等合规要素贯穿于医疗器械企业日常运营中,实现研发,采购,生产,库管,人员管理,设备管理,环境管理,售前售后等环节与合规要素的有机结合。 2 体系建立运行(3-6个月) 大量的三类IVD产品实操经验 3 委托研发 4 原材料、工艺验证(4周) 全国布局10+CDMO工厂,均具备新冠抗原IVD产品的生产、质量能力;工厂配备有完整的生产、质量管理团队 5 试产3批(2周) 研究院+法规中心+CDMO团队,均有资深的IVD技术专家。 6 注册检验(1.5个月) 7 临床试验(3-6个月) 强大的全球资源以及执行团队,确保临床试验3-6个月高速完成 根据审评原则,临床试验的性能评价部分可接受境内或境外数据,对此,奥咨达拥有绝对优势 8 审评取证 9 量产销售 奥咨达法规团队,进行多次模拟飞检。 奥咨达强大的临床资源
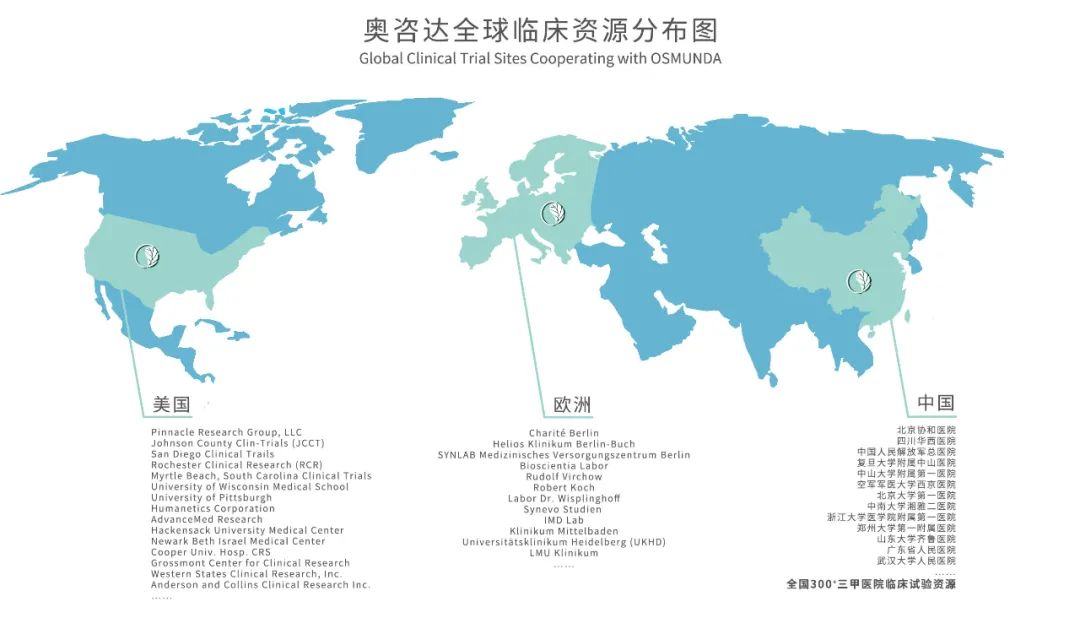
临床资源有限!! 一刻值千金!! 机会不等人!!
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632