OLABS ∨
解决方案 ∨
国家药监局关于发布需进行临床试验审批的第三类医疗器械目录(2020年修订版)的通告(2020年第61号)
2020年9月18日 发布
为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》和国务院深化“放管服”改革要求,进一步加强医疗器械临床试验的管理,维护医疗器械临床试验过程中受试者权益,推进监管科学研究成果转化,提高审批效率,加快产品上市,根据《医疗器械监督管理条例》,国家药品监督管理局组织对需进行临床试验审批的第三类医疗器械目录进行了修订,并于2020年9月18日对外发布,自发布之日起施行。
《关于发布需进行临床试验审批的第三类医疗器械目录的通告》(国家食品药品监督管理总局通告2014年第14号)同时废止。
国家药监局
2020年9月14日
需进行临床试验审批的第三类医疗器械目录(2020年修订版)
与境内外已上市产品相比,采用全新设计、材料或机理,和/或适用于全新适用范围,且对人体具有较高风险的医疗器械,应当经临床试验审批后方可在中国开展临床试验。上述原则适用的具体品种类别如下:
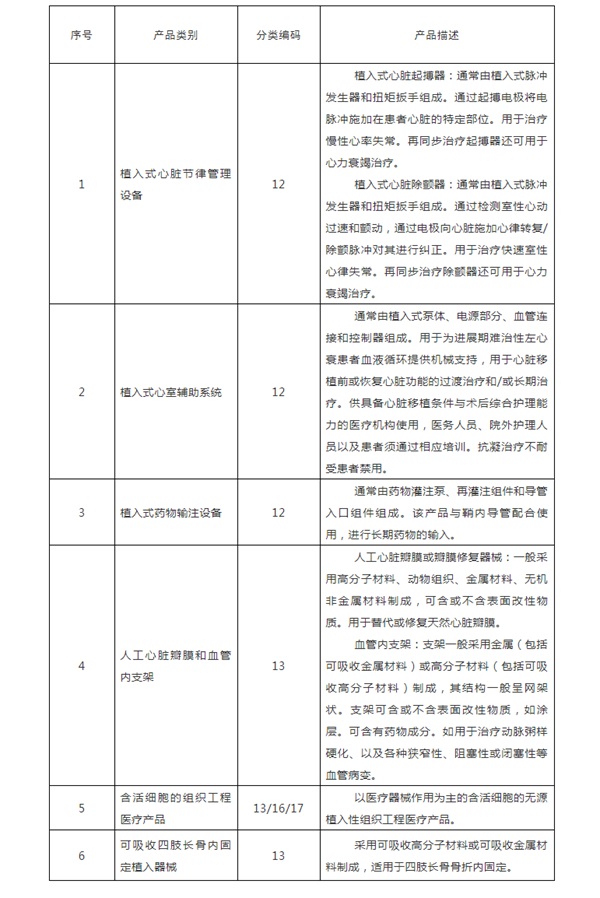
《需进行临床试验审批的第三类医疗器械目录(2020年修订版)》修订说明
2014年10月1日,原国家食品药品监督管理总局组织制定发布了《需进行临床试验审批的第三类医疗器械目录》,对规范医疗器械临床试验的开展发挥了积极作用。
为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》和国务院深化“放管服”改革要求,进一步加强医疗器械临床试验的管理,维护医疗器械临床试验过程中受试者权益,推进监管科学研究成果转化,提高审批效率,加快产品上市,根据《医疗器械监督管理条例》,国家药品监督管理局组织对需进行临床试验审批的第三类医疗器械目录进行了修订,发布了《需进行临床试验审批的第三类医疗器械目录》(2020年修订版)。修订的目录增加了适用产品的共性原则描述,调整了6项目录产品描述,删除了2项产品,更新了分类编码。具体包括:
一、增加适用产品的共性原则描述,即“与境内外已上市产品相比,采用全新设计、材料或机理,和/或适用于全新适用范围,且对人体具有较高风险的医疗器械,应当经临床试验审批后方可在中国开展临床试验。”调整后的目录以“共性原则+产品描述”的形式提供,同时满足两部分内容要求,则可以判定为本目录适用产品。此外,原目录中部分产品描述为“境内市场尚未出现的”或未明确限定,修订后目录将共性原则确定为“与境内外已上市产品相比”,更加符合“风险—受益”评价理念和监管科学要求。
二、调整部分产品类别和描述。将“植入式心脏起搏器、植入式心脏除颤器、植入式心脏再同步复律除颤器”调整为“植入式心脏节律管理设备”,“植入式血泵”调整为“植入式心室辅助系统”,“植入式药物灌注泵”调整为“植入式药物输注设备”,“境内市场上尚未出现的血管内支架系统”调整为“人工心脏瓣膜和血管内支架”;将“境内市场上尚未出现的植入性人工器官、接触式人工器官、骨科内固定产品及骨科填充材料”调整为“含活细胞的组织工程医疗产品”;将“可吸收四肢长骨内固定产品”调整为“可吸收四肢长骨内固定植入器械”。相应的产品描述也进行了细化和明确。
三、删除部分产品类别。删除“定制增材制造(3D打印)骨科植入物”和“纳米骨科植入物”。
四、更新医疗器械分类编码。根据《医疗器械分类目录》,明确了产品所属分类目录中子目录编码,考虑到部分产品尚无一级或二级目录,为了统一分类编码表述,暂不细化到一级和二级目录。
文章来源于国家药监局,全文由奥咨达整理。了解更多关于医疗器械临床试验的政策法规及行业资讯,请关注奥咨达动态。
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632