OLABS ∨
解决方案 ∨
上海市药品监督管理局关于本市调整
境内第三类医疗器械注册质量管理体系核查申报材料要求的通告
为深入推进“一网通办”相关工作,紧贴企业办理需求,减少申请人跑动次数,我局通过“网络核验”“电子签章”等技术改造,将本市医疗器械生产企业递交的境内第三类医疗器械注册体系核查申报材料,由递交纸质材料的方式调整为递交电子材料,实现企业网上申报、在线受理并开展审查办理,现将有关事项通告如下:
自2020年5月6日起,我局行政服务中心不再收取境内第三类医疗器械注册体系核查纸质申报材料,申请人需在网上(网址:http://xuke.smda.sh.cn)递交以下电子申报材料:
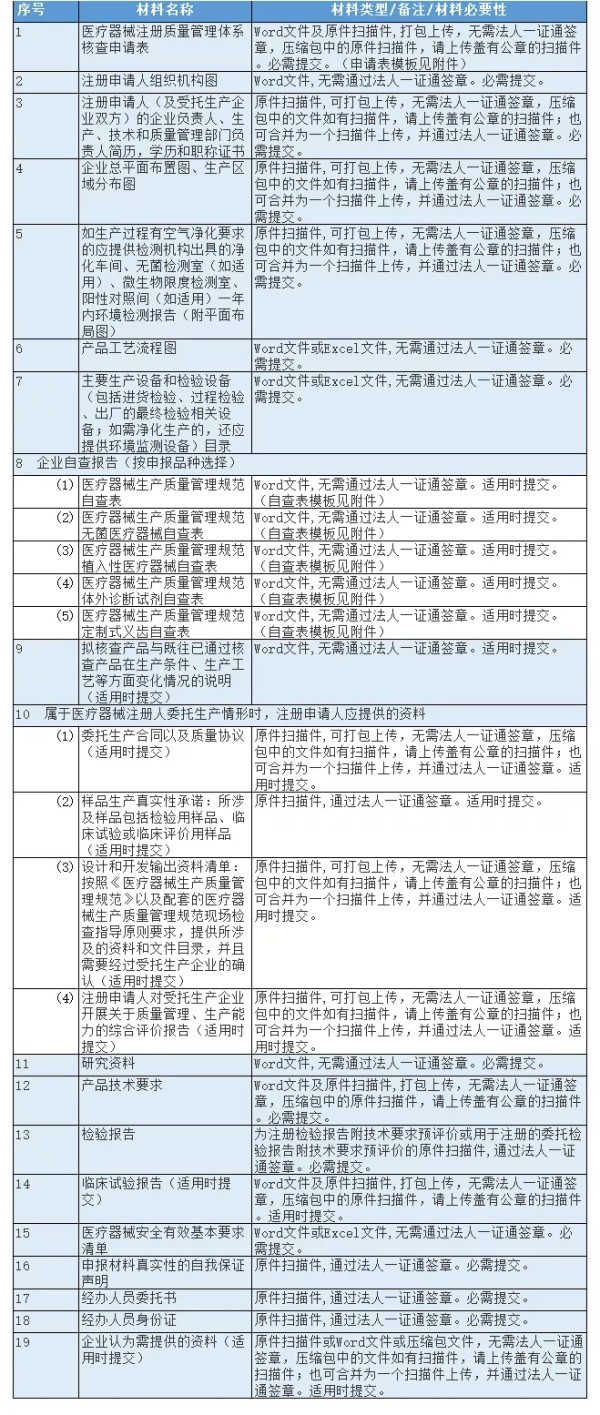
申请人在遇到浏览器设置等技术问题时,可与技术保障人员联系(电话:021-61675651)。
特此通告。
上海市药品监督管理局
2020年4月30日
以上内容来源于上海药监局,了解更多关于医疗器械注册的内容,请关注奥咨达资讯中心。
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632