OLABS ∨
解决方案 ∨
2019
国家创新医疗器械优先审批统计
2019.01.06 奥咨达出品
近年来,为贯彻落实国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)和中办国办《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),深入推进医疗器械审评审批制度改革,国家药监局制定发布了《创新医疗器械特别审批程序》以及《医疗器械优先审批程序》,促进了医疗器械创新发展,保障医疗器械临床使用需求。
《创新医疗器械特别审批程序(试行)》自2014年3月1日起实施,四年后修订、2018年12月1日起施行的《创新医疗器械特别审查程序》(简称:创新程序),对拥有我国发明专利、技术上具有国内、国际优秀水平,并且具有显著临床应用价值的医疗器械产品设置了特别审批通道。创新程序的实施,对保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进了新技术的推广和应用,推动医疗器械产业向高质量发展起到了积极的作用。
根据奥咨达中国医疗器械产业数据库统计,2019年国家局公示的创新医疗器械40个、批准上市的有20个,均比2018年同比略降。这可能是新修订的创新程序刚实施,在适用情形、申请流程、审查实效性、审查方式和通知形式等内容进行了调整所致。
图1:2014年至今国家创新医疗器械
公示和取证情况
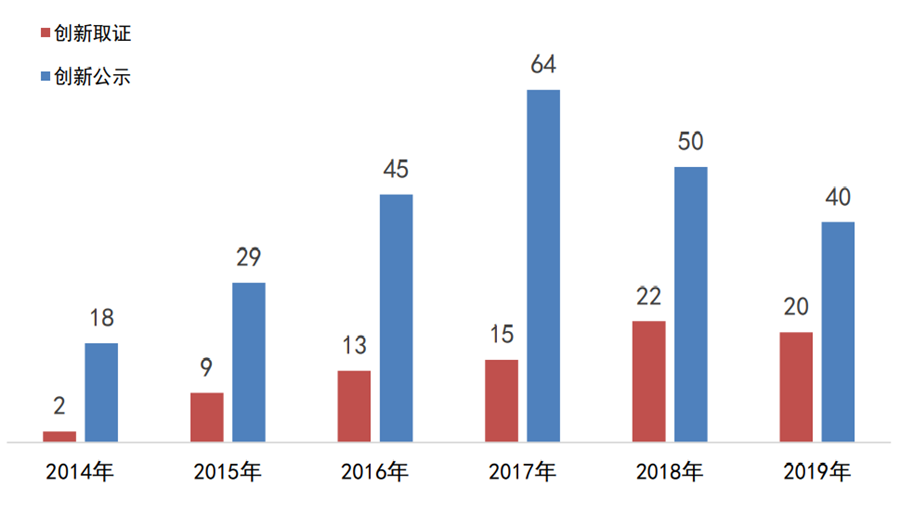
数据来源:国家局、器审中心,奥咨达整理
创新程序自2014年实施至今,国家局共公示了246个创新产品,其中有源产品110个、无源产品99个、IVD产品37个;国产216个、进口30个。
图2:2014年至今国家创新医疗器械公示——
产品分类占比
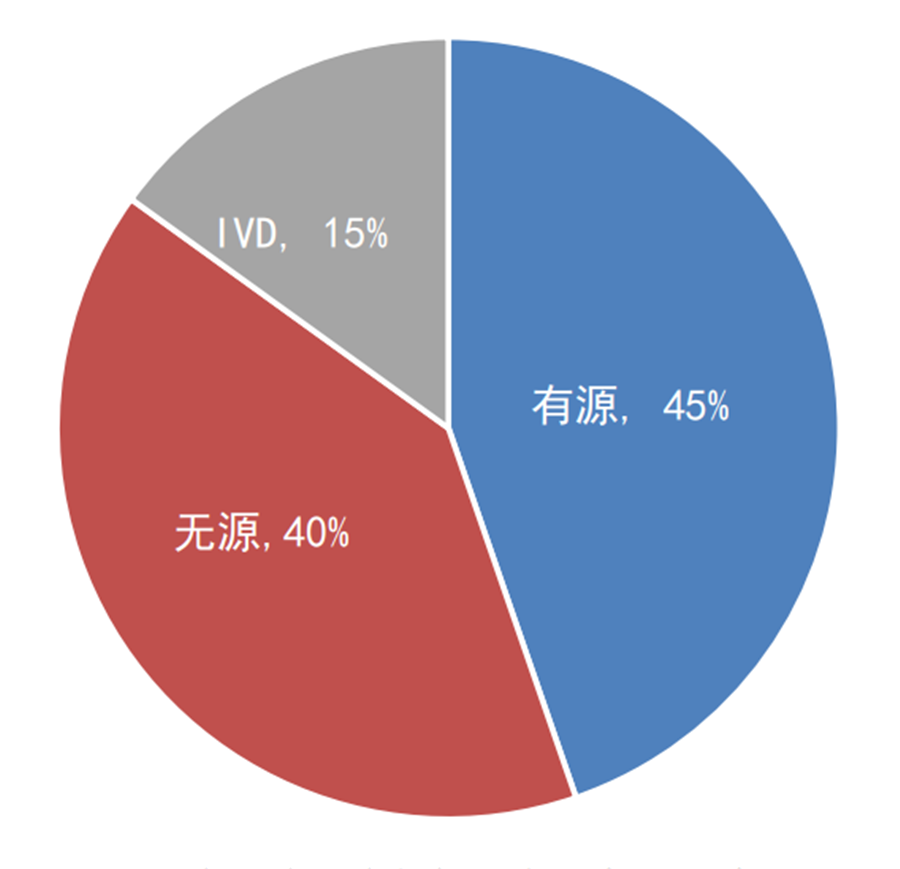
数据来源:国家局、器审中心,奥咨达整理
图3:2014年至今国家创新医疗器械公示——
国产/进口
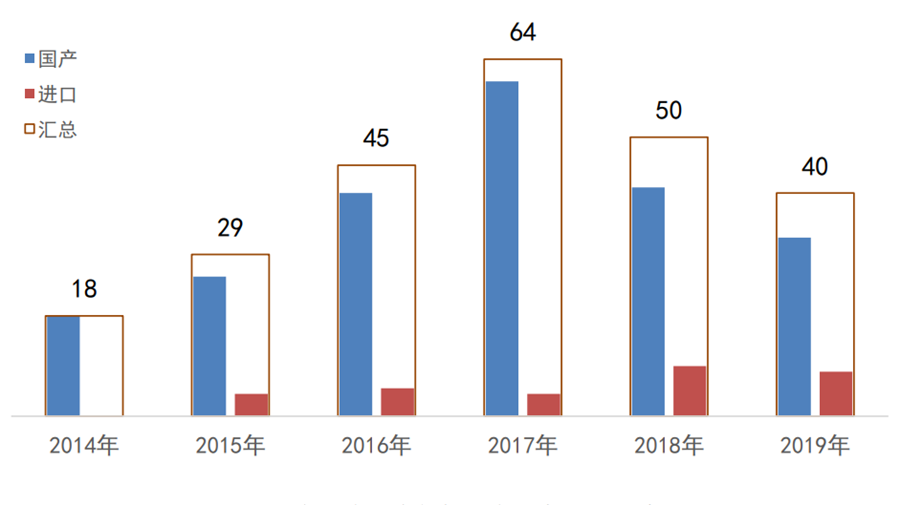
数据来源:国家局、器审中心,奥咨达整理
截止2019年底,81个国家创新医疗器械取得上市批准,其中一个是进口产品。在取证的创新国产器械中,企业分布在全国13个省(直辖市)。除了位列前五的北京、上海、广东、江苏、浙江传统强省市外,陕西、甘肃和安徽实现了零的突破,反映了医疗器械产业已经成为各地提升健康产业、生物医药产业和高端装备制造业的重要抓手。
图4:2014年至今国家创新医疗器械省市分布
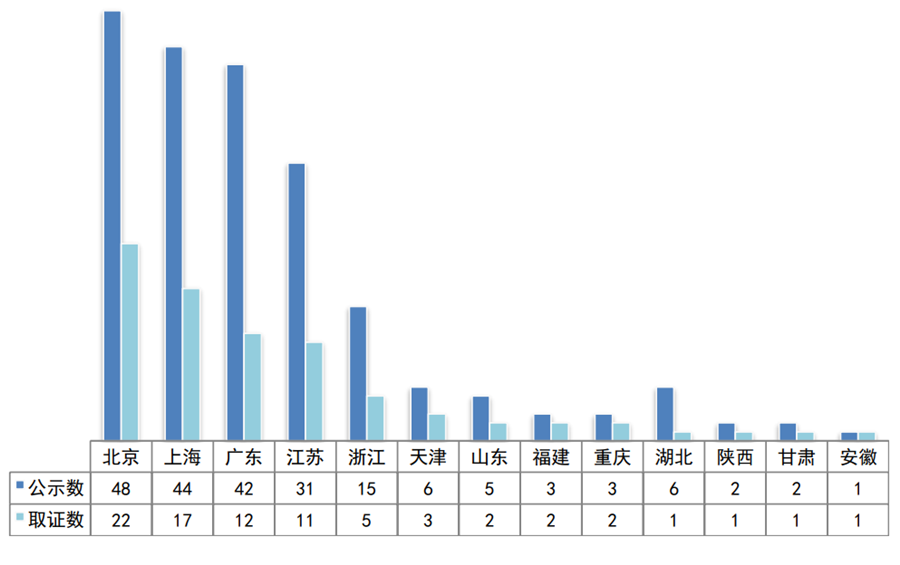
数据来源:国家局、器审中心,奥咨达整理
说明:取得国家创新产品批件的省市共19个,本图只显示创新产品已取证的13个省市。
为了加快“诊断或者治疗罕见病、恶性肿瘤、老年人特有和多发疾病、专用于儿童、临床急需等医疗器械,以及列入国家科技重大专项或国家重点研发计划的”医疗器械审评审批,国家局制定了《医疗器械优先审批程序》(简称:优先程序),于2017年1月1日开始实施。
对确定予以优先审批的项目,监管部门将全环节加快审评审批效率,优先进行技术审评,优先安排医疗器械注册质量管理体系核查,优先进行行政审批,缩短产品上市时间,保证相应成果和产品能够尽快应用于临床使用。
2019年,国家局共公示了14个优先审批的医疗器械项目。其中,国产10个、进口4个,入选理由依次是科技重大专项、临床急需、治疗罕见病、重点研发计划和治疗恶性肿瘤等。同年,一共11个产品优先审批上市,其中IVD产品7个、有源无源各2个。
图5:2019年国家优先审批医疗器械公示情况
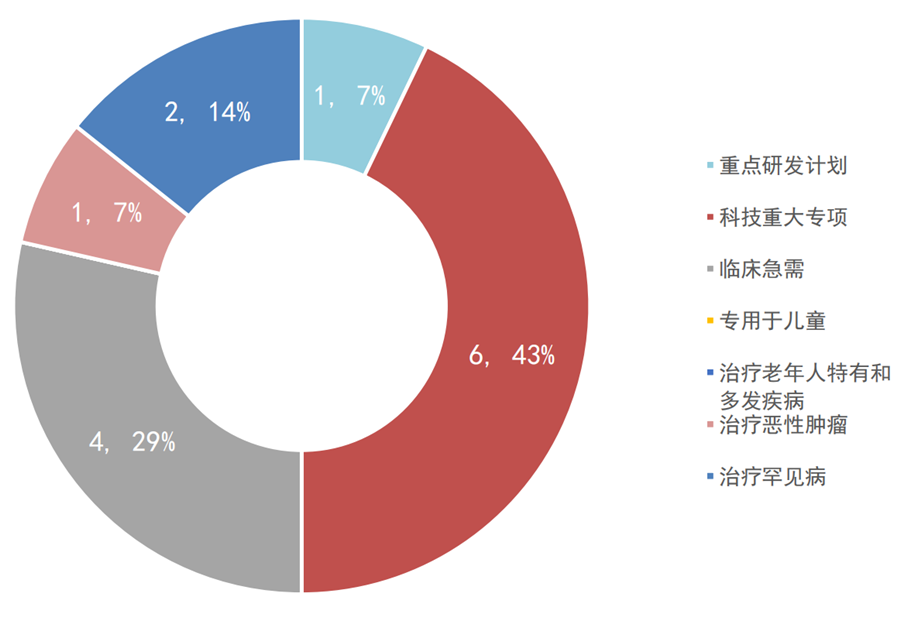
数据来源:国家局、器审中心,奥咨达整理
图6:2019年国家优先审批的医疗器械清单
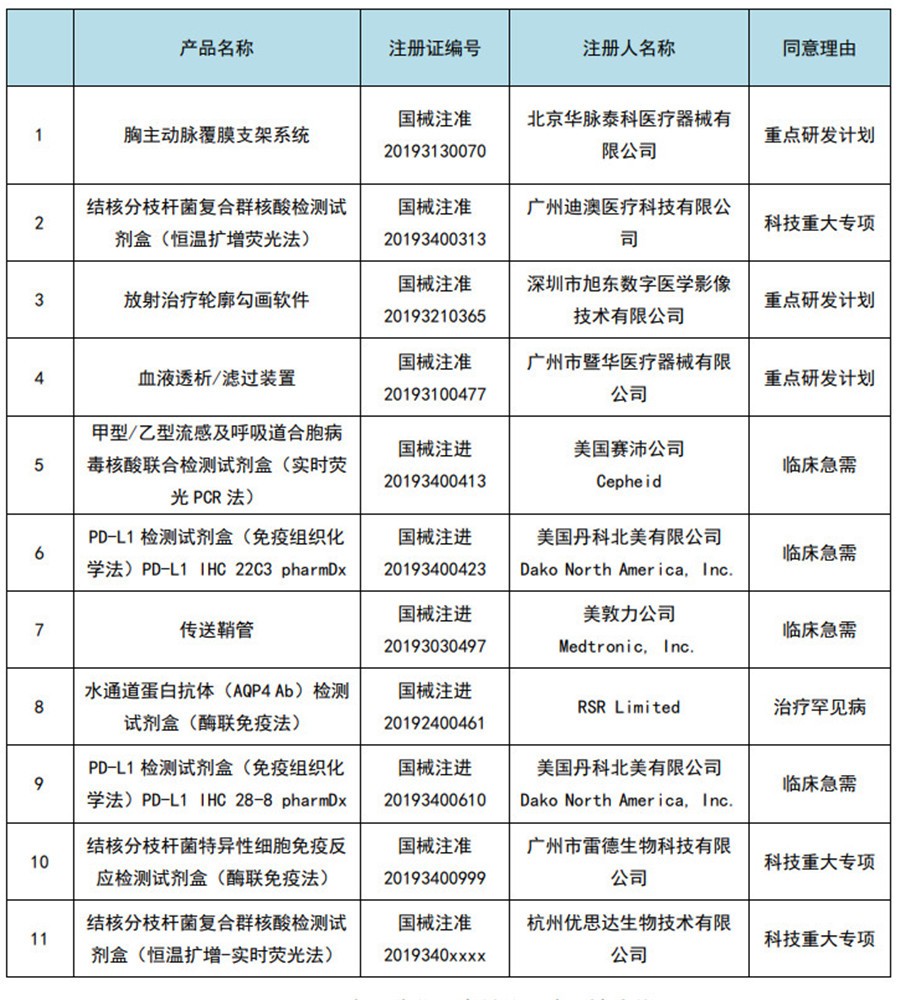
数据来源:国家局、器审中心,奥咨达整理
2017年实施优先程序至今,国家局一共公示了34个优先审批产品,其中国产24个、进口10个;以重点研发计划和临床急需入选的产品占比最大、各有11个,其次是科技重大专项8个,治疗罕见病3个,治疗恶性肿瘤1个,至今未见专用于儿童治疗、或老年人特有和多发疾病的器械上榜。
此外,截止2019年底,共有18个医疗器械产品通过优先审批取得上市许可,其中进口产品5个(美国4个、英国1个);国产产品13个、分别来自12家企业、6个省市。广东省以8个优先公示、6个取证独占鳌头,北京和湖北紧跟其后。
图7:2017年至今国家优先审批的医疗器械
公示和取证情况
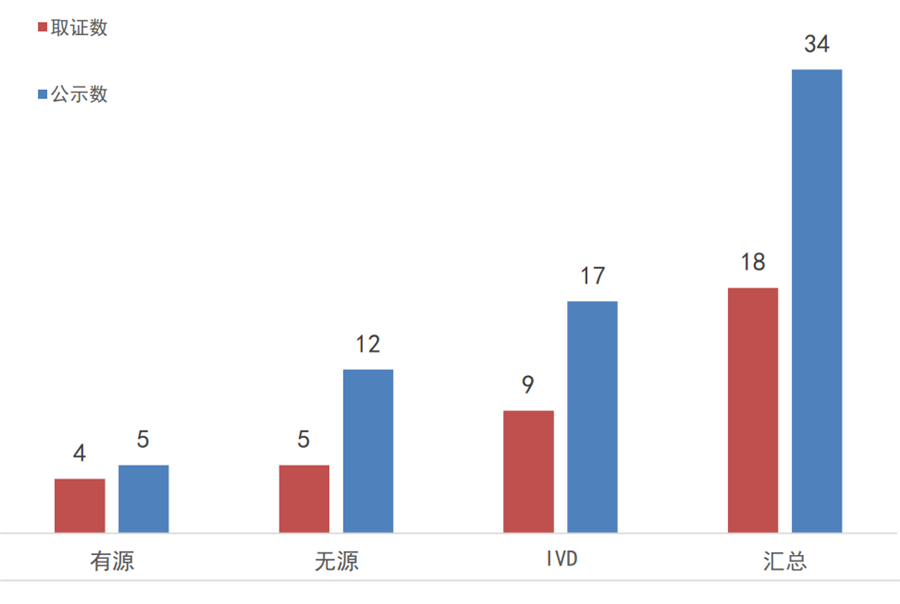
数据来源:国家局、器审中心,奥咨达整理
图8:2017年至今国家局优先审批的医疗器械
省市分布
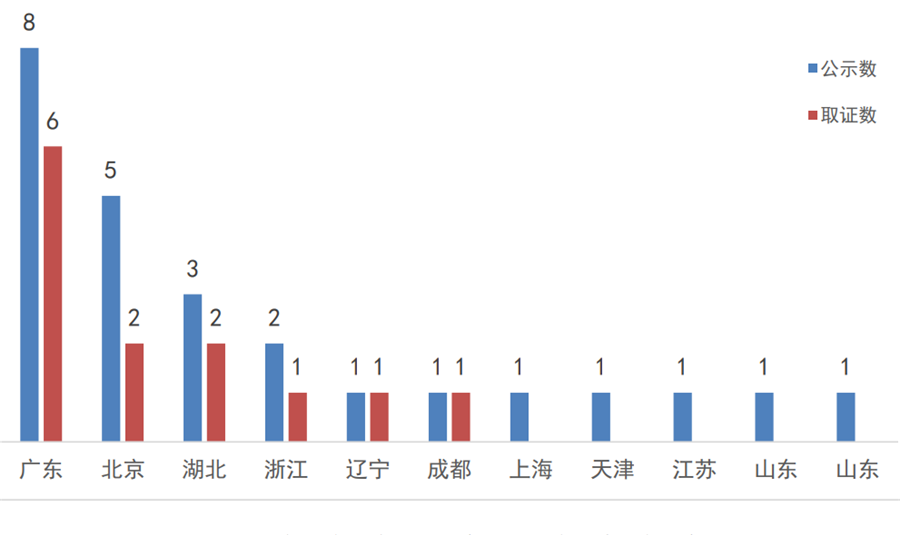
数据来源:国家局、器审中心,奥咨达整理
医疗器械的创新程序和优先程序虽各有不同,但都是医疗器械上市审批的快速通道,如优先审批的产品从受理到发证最短只有5个月,两者在加速医疗器械创新发展、满足人民群众的临床急需、推进行业高质量发展方面,均起到积极重要的作用。
• END •
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632