OLABS ∨
解决方案 ∨
医疗器械临床试验在各国的法规注册过程中,都是很重要的医疗器械注册资料。目前国内医疗器械公司绝大多数没有专题一页的研发和法规团队,因此对相关方面信息了解甚少,也无法根据相关要求规划和指导研发、注册工作。因此医疗器械临床试验实施是目前很多企业的难点工作,因此许多医疗器械公司会选择奥咨达CRO服务,使得申办方更专业、更有效、更易成功以及更能降低成本的完成此项工作。
1)在中国NMPA注册没有在豁免医疗器械产品目录中的的二三类医疗器械产品都必须要进行医疗器械临床试验(即临床验证);
2)美国的很多产品根据美国的标准和相应的法规指南文件,也需要开展医疗器械临床试验,临床试验资料作为FDA 510k或者PMA注册认证的必须文档之一;
3)欧盟的部分产品,包括很多IIb以及III类的产品,都需要临床试验资料;欧盟的体外诊断产品,根据IVDD指令的要求。特别是List A和list B 的很多产品,都必须开展临床试验。
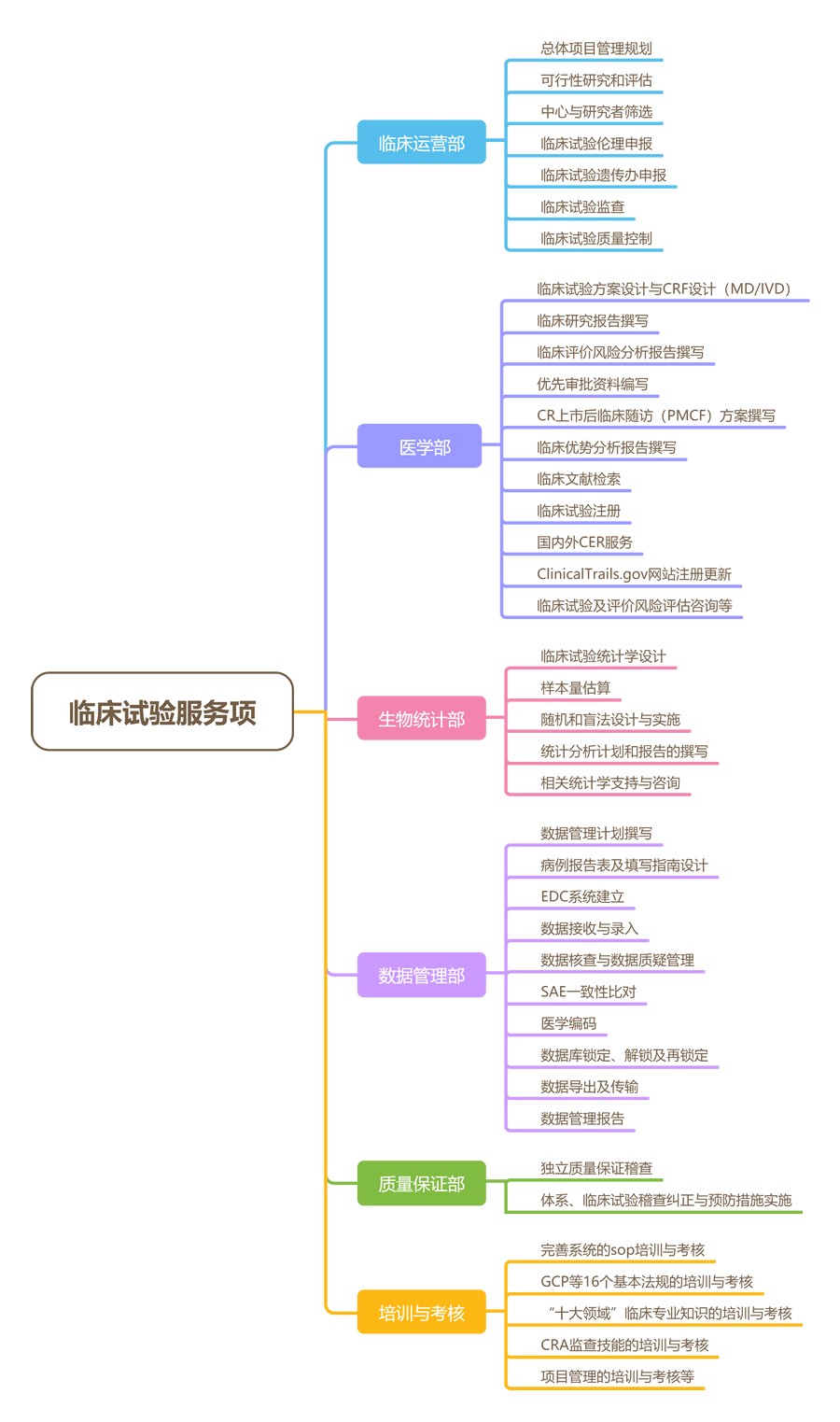
奥咨达临床试验服务如下:
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632