OLABS ∨
解决方案 ∨
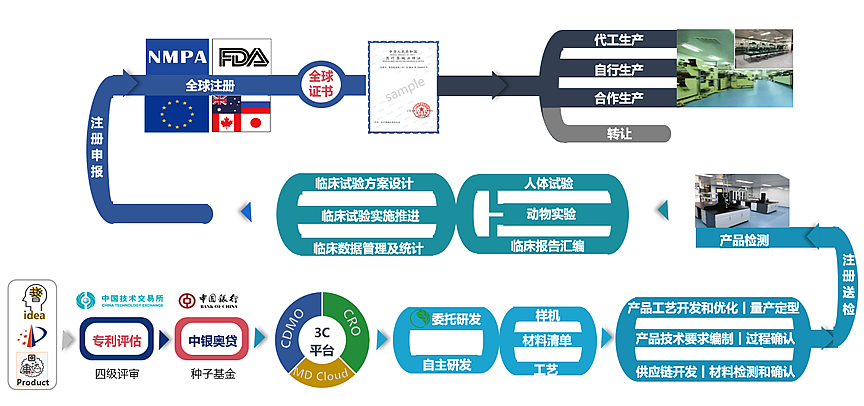
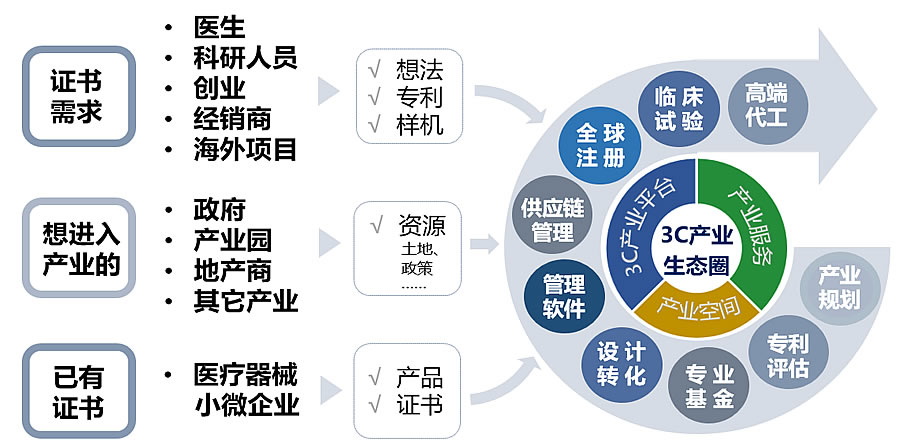
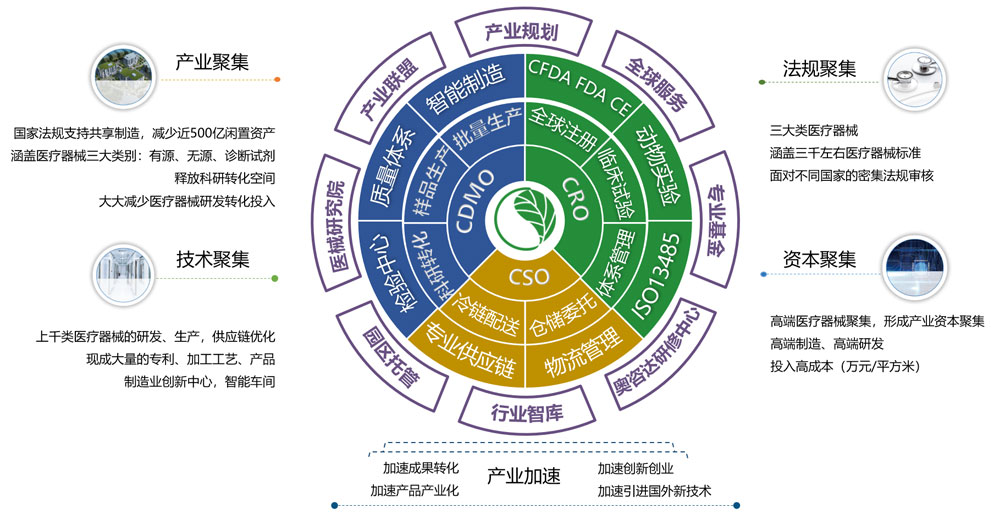
奥咨达拥有强大的医疗器械专业数据库、项目管理平台和研发制造基地(有源器械生产基地、无源器械生产基地、诊断试剂生产基地)。五百多位医疗器械技术专家分布在北京、上海、广州、深圳、苏州、成都及海外美国、德国等12家全资分公司中。奥咨达将有9家专业CDMO落地中国,为全球医疗器械研发者、生产者、使用者和政府提供全方位、一站式的医疗器械产业解决方案。
 医生/医院解决方案
医生/医院解决方案
 科研院校解决方案
科研院校解决方案
 初创企业解决方案
初创企业解决方案
 经营企业解决方案
经营企业解决方案
 投融资机构解决方案
投融资机构解决方案
临床优秀技术及产品快速落地转化
获取医疗器械注册证时间缩短1年+
成本投入减少50%
提供3000多种法规支持
政策解读及市场策略指导

提供孵化配套服务,助力优秀项目及产品产业化落地
获取医疗器械注册证时间缩短1年+
成本投入减少50%
提供3000多种法规支持

获取医疗器械注册证时间缩短1年+
成本投入减少50%
提供3000多种法规支持
完善的技术及人才支持

孵化建立自有品牌
提供政策解读及业务转型指导
提供3000多种法规支持
获取医疗器械注册证时间缩短1年+
成本投入减少50%

提高投资效率
降低试错成本
快速获取行业优秀项目/产品信息
提供3000多种法规支持
投资成本减少50%
获取医疗器械注册证时间缩短1年+

序号 |
文件名 |
发文单位 |
1 |
国务院 |
|
2 |
国家食品药品监督管理总局 |
|
3 |
国家食品药品监督管理总局 |
|
4 |
中共中央办公厅、国务院办公厅 |
|
5 |
国家食品药品监督管理总局令第7号 |
|
6 |
司法部 |
|
7 |
国务院 |
|
8 |
国务院 |
|
9 |
国务院 |
|
10 |
国务院 |
|
11 |
原国家食品药品监督管理局 |
|
12 |
原国家食品药品监督管理局 |
|
13 |
上海市食品药品监督管理局 |
|
14 |
上海市食品药品监督管理局 |
|
15 |
上海市食品药品监督管理局 |
|
16 |
上海市食品药品监督管理局 |
|
17 |
上海市食品药品监督管理局 |
|
18 |
关于《中国(上海)自由贸易试验区内医疗器械注册人质量管理体系实施指南》和《中国(上海)自由贸易试验区内医疗器械注册人委托生产质量协议编写指南》公开征求意见的通知 |
上海市食品药品监督管理局 |
19 |
上海市食品药品监督管理局 |
|
20 |
上海市人民政府办公厅 |
|
21 |
国家发改委 |
|
22 |
国务院 |
|
23 |
海南省委、省政府办公厅 |
|
24 |
国务院 |
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632