OLABS ∨
解决方案 ∨
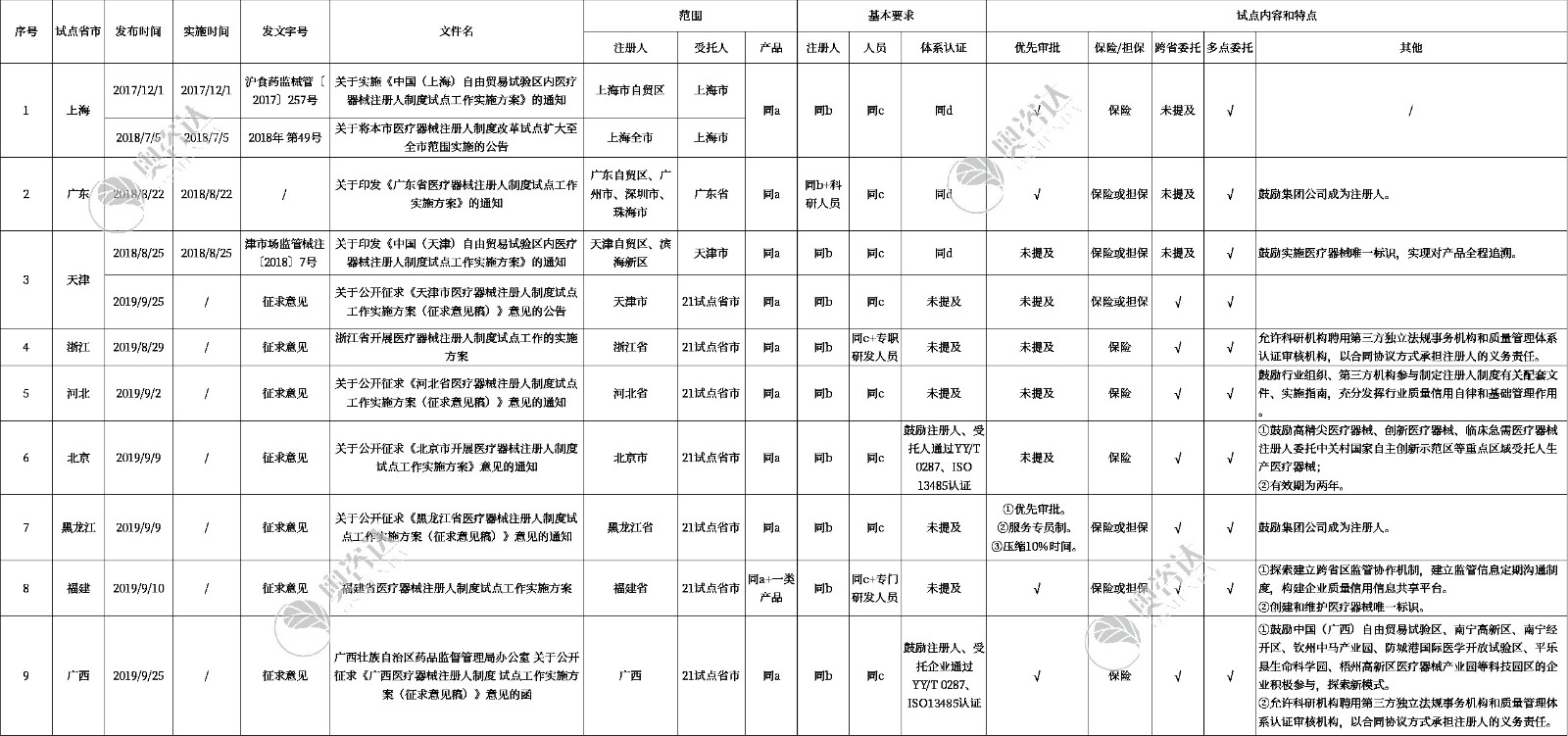
点击查看大图 a.产品范围:2、3类医疗器械(含创新产品),国家禁止委托目录的产品除外 b.注册人主体:企业、科研机构 c.人员基本要求:专职的管理者代表、质量管理人员、法规事务人员、上市后事务人员,不得互相兼职 d.受托生产3类医疗器械,需有YY/T 0287 或 ISO 13485 认证证书
部分素材来源:中国食品药品网、中国医疗科技网
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632