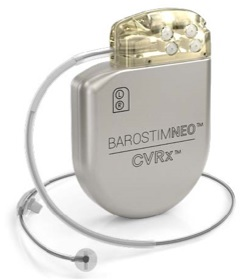
美国食品药品监督管理局(FDA)于2019年8月16日批准了一款用于改善心衰患者生存质量的颈动脉窦刺激器(BAROSTIM NEO®)。颈动脉窦压力感受器是人体天然的血液动力调节系统。BAROSTIM NEO系统通过刺激颈动脉压力感受器,触发自身血液动力调节系统。在某些情况下,例如高血压和心力衰竭,颈动脉窦压力感受器功能不正常,不能向大脑发送充足的生理信号。这导致大脑向身体(心脏、血管、肾脏)发出收缩血管、肾脏保水和盐、增加血压相关激素释放的信号。当颈动脉窦压力感受器被激活时,刺激信号就会被发送给大脑。作为反馈,大脑通过向身体其他部位(心脏、血管和肾脏)发出放松血管、抑制血压相关激素释放来抵消这种刺激。这种变化的直接作用是减少心脏后负荷、使心脏排出量增加,进而使心脏的工作负荷降低。BAROSTIM NEO由植入式脉冲发生器(IPG)、颈动脉窦电极导联和编程器组成。IPG通过电极向晚期心力衰竭患者的颈动脉窦压力感受器发送电信号。而医务人员则通过编程器对设备进行控制。医生首先将BAROSTIM NEO的IPG植入患者左侧或右侧锁骨下方,并在患者左侧或右侧颈动脉窦处放置颈动脉窦电极。然后将IPG连接到颈动脉窦电极。医生根据患者病情对IPG进行编程。IPG通过电极向颈动脉窦压力感受器发送电信号。BAROSTIM NEO系统适用于对心衰药物治疗无效、NYHA III级或II级(近期出现III的情况),左室射血分数≤35%,NT-proBNP<1600 pg/ml的晚期心力衰竭患者。或者根据AHA/ACC/ESC指南不适合接受心脏再同步化治疗(CRT)的患者。如果患者存在以下情况则被禁止使用该设备:被评估为双侧颈动脉分叉位于下颌骨平面以上;颈动脉窦压力感受器损伤或自主神经功能紊乱;未得到有效控制的缓慢型心律失常;经超声或血管造影发现颈动脉粥样硬化狭窄大于50%;超声或血管造影发现存在颈动脉溃疡性斑块;已知对硅酮或钛过敏。该设备在使用过程中常见的不良事件主要为:中风、短暂性缺血发作(TIA)、全身栓塞、外科或麻醉并发症、感染、伤口并发症、动脉损伤、疼痛、神经损伤/刺激、低血压、高血压危象、心律失常、IPG移位、颈动脉窦压力感受器损伤、纤维化、过敏反应、对使用者或皮下的一般损伤、再手术治疗、心力衰竭加重、心律失常、死亡等。申办方使用3只绵羊对12个测试样品进行为期180天的动物试验,以评价BAROSTIM NEO系统的安全性。与对照组相比,180天的动物试验中没有发现器械缺陷、组织病理学改变或与设备有关的不良事件。随后,申办方在美国和英国共92家中心开展人体临床研究,以合理的评价BAROSTIM NEO系统缓解心力衰竭症状的安全性和有效性(IDE G120010)。该临床试验数据是PMA批准的决定依据。该临床试验采用前瞻性、多中心、随机对照研究的方式,自2016年4月5日开始至2019年4月22日结束,共入组408例受试者。受试者按1:1的方式随机进入试验组和对照组,试验组的治疗措施为器械+最佳的药物治疗,而对照组仅采用最佳的药物治疗。在筛选期,受试者经4周最佳的稳定药物持续治疗(轻微调整除外)达到症状稳定后才能参加该临床试验。对照组与试验组的筛选程序一致。试验组的访视开始日期以器械植入为始,而对照组的随访日期则是以随机分组日期为始。该临床试验分为两个阶段。第一阶段主要通过收集所有受试者第6个月的临床试验数据(明尼苏达州心力衰竭患者生活质量调查(MLWHF QOL)、6分钟步行试验(6MHW)、NT-proBNP、试验组的主要神经/心血管不良事件(MANCE))以获得PMA批准。第二阶段主要通过收集上市后的长期临床使用数据以评估设备的长期安全性和有效性。为保证临床试验质量,注册临床试验采用分组隐匿,NT-proBNP中心实验室检测,由独立的临床事件委员会(CEC)、数据监查委员会(DMC)和不良事件委员会(AEC)对所有心衰住院和失访进行分析并对临床试验进行质控。最后,由独立医生组成的执行指导委员会(ESC)协助申办方制定和执行方案。第一阶段临床试验最早于2018年10月结束,此时试验组共入组139例,对照组共入组155例。试验结果显示MANCE未发生率为94.4%(95%可信区间下限89.7%)、6MHW、QOL均达到最初的研究假设,但NT-proBNP并没有满足研究假设。经进一步分析后发现,NYHA III级或II级(近期出现III的情况),左室射血分数≤35%,NT-proBNP<1600pg/ml的晚期心力衰竭患者对设备的干预效果最为敏感。为此,申办方以该适应证为受试者筛选依据,继续入组符合要求的受试者。最终于2019年4月22日完成第一阶段临床试验,此时共入组408例受试者,其中试验组有130例,对照组有134例受试者符合新的适应证要求。对这264例受试者进行分析后,结果显示:MANCE未发生率为96.8%(95%可信区间下限92.8%);试验组6个月6MHW变化量为48.6±66.3m,对照组6个月6MHW变化量为-7.9±88.4m;试验验组6个月QOL变化量为-20.7±25.4,对照组6个月QOL变化量为-6.2±20.1;试验验组6个月NT-proBNP变化量为-21.1±0.4%,对照组6个月NT-proBNP变化量为3.3±0.3%。最终所有的评价指标均满足最初的研究假设,产品被批准上市。心衰是目前最常见的慢性疾病,探索心衰的全新治疗方式也是各医疗企业不断攻克的领域,BAROSTIM NEO系统是研发心衰全新治疗方式的胜利者,为人类的医学进步又作出的重要的贡献。但我们也应该清晰的认识到,全新产品研发是一个动态的持续过程,需要研发人员不断探索,通过一系列试验以寻找合适的目标人群、治疗部位、治疗方式、治疗周期等。因此,全新产品在开展注册临床试验前,进行探索性研究至关重要。探索性研究能更好的了解产品,确定产品预期用途、选择合适的研究设计、降低临床试验风险。从该产品的注册临床试验过程我们可以看出,申办方一开始并没有打算进行探索性研究,但临床试验按原计划完成并进行统计分析后,申办方才发现某些评价指标并没有达到最初的研究假设,此时对数据进一步分析后才发现该产品最佳的目标人群。最终通过补充目标人群样本量,继续进行临床试验,其注册临床试验的结果才满足PMA注册要求,而最终的受试者人数达到408例。若申办方一开始就进行探索性研究可能并不需要这么多样本量。临床试验是一个环环相扣的过程,申办方需要根据产品的研发阶段开展不同的临床试验,以便科学合理的验证产品。1、心脏再同步治疗( Cardiac Re-synchronization Therapy, CRT)心律失常是不规则的心律,可能由多种原因引起,包括年龄、心脏损伤、药物和遗传。在心力衰竭患者中,CRT或双心室起搏用于帮助改善心脏节律和与心律失常相关的症状。通过在锁骨下方植入一个硬币大小的起搏器,并连接设备的三根导线以监测心率,当检测到心率出现不规则搏动时,发出微小的电脉冲来纠正它们。类似于“重新同步”心脏搏动。由于CRT可提高心脏的效率并增加血流量,因此一些心力衰竭症状患者的症状得以缓解。临床研究还表明CRT可以降低住院率和发病率并改善生活质量。一般而言,CRT适用于其左心室和右心室不会同时搏动的中度至重度症状心力衰竭患者。CRT并不适用于轻度心力衰竭症状、舒张性心力衰竭,也不适合那些没有通过药物疗法充分探索纠正病情的患者。颈动脉窦位于颈内动脉的起始部。此处血管壁略薄而管腔微膨大,故称颈动脉窦。除反刍动物以外,几乎所有哺乳动物均有颈动脉窦。其机能解剖特点是窦壁外膜发达,内含大量胶原纤维,中膜平滑肌稀少,弹性纤维较多。在窦壁的外膜深层有压力感受性神经末梢装置,即颈动脉窦压力感受器;在窦腔腹侧面有化学感受性神经末梢装置,即颈动脉化学感受器。https://www.fda.gov/medical-devices/recently-approved-devices/barostim-neo-system-p180050t
作者:奥咨达医疗器械服务集团 临床事业部
