OLABS ∨
解决方案 ∨

2019年,我们将迎来中华人民共和国70周年华诞,是全面建成小康社会关键之年,中国经济的发展必定更加迅速。作为健康行业的细分板块,医疗器械行业近年来一直保持高于同期国民经济发展的幅度。
今年我国医疗器械行业仍保持快速增长态势,不断出台的新政策为产业发展增添了助推剂。此法规月刊的内容有:行业概况、监管动态、注册数据、创新优先、精品分享。
1
行业概况
2
监管动态
法规文件
重点法规节选:
2019年7月3日,国家药监局综合司 国家卫生健康委办公厅关于印发医疗器械唯一标识系统试点工作方案的通知
2019年7月4日,国家药监局、国家卫生健康委关于发布定制式医疗器械监督管理规定(试行)的公告
2019年7月10日,国家药监局发布《关于医疗器械电子申报有关资料要求的通告》、《医疗器械产品注册项目立卷审查要求(试行)》等通告
2019年7月12日,国家药监局关于发布医疗器械生产质量管理规范附录独立软件的通告
2019年7月15日,国务院关于实施健康中国行动的意见
2019年7月31日,国务院办公厅关于印发治理高值医用耗材改革方案的通知
表 1 2019年1~7月法规文件发布
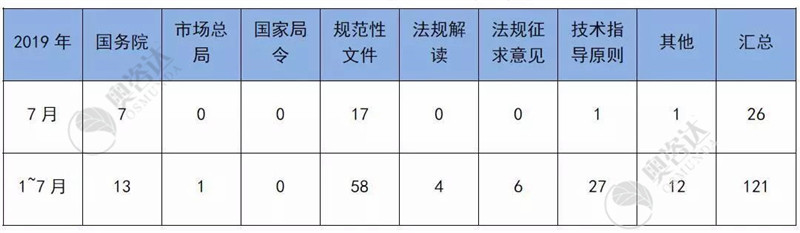
来源:NMPA官网,奥咨达整理。
2019年月均与2018年月均同比情况如下图 1所示。国家对医疗器械行业越来越重视,监管力度亦是有增无减。同时,国家局文件的法规解读同比2018年增长71.43%,以便广大监管人员和企业加深对政策法规的理解,更利于法规的落实和执行。

图1 2019年较2018年法规文件月均发布数量同比情况
来源:NMPA官网,奥咨达整理。
技术规范
一、技术指导原则
2019年7月,国家局共发布1篇技术指导原则,具体情况如下:
表2 2019年7月技术指导原则
来源:NMPA官网,奥咨达整理。
2019年1~7月,国家局共发布技术指导原则27篇:
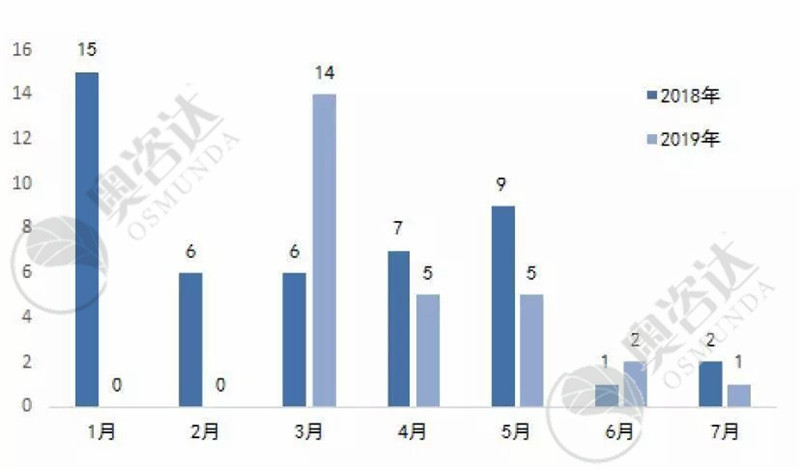
图2 2019年较2018年每月同比情况
来源:NMPA官网,奥咨达整理。
二、医疗器械标准
2019年1月29日 关于批准发布YY1298—2016《医用内窥镜 胶囊式内窥镜》医疗器械行业标准第1号标准修改单的公告
2019年6月6日关于发布YY 0096—2019《钴-60远距离治疗机》等27项医疗器械行业标准和1项修改单的公告(2019年 第47号)
2019年7月30日关于发布YY_T 0506.8—2019《病人、医护人员和器械用手术单、手术衣和洁净服 第8部分:产品专用要求》等24项医疗器械行业
2019年7月的行业标准具体情况如表3:
表3 2019年7月标准具体情况
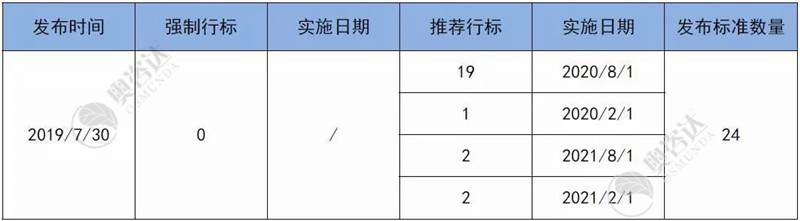
来源:NMPA官网,奥咨达整理。
2019年-2021年实施的医疗器械标准数量如下:
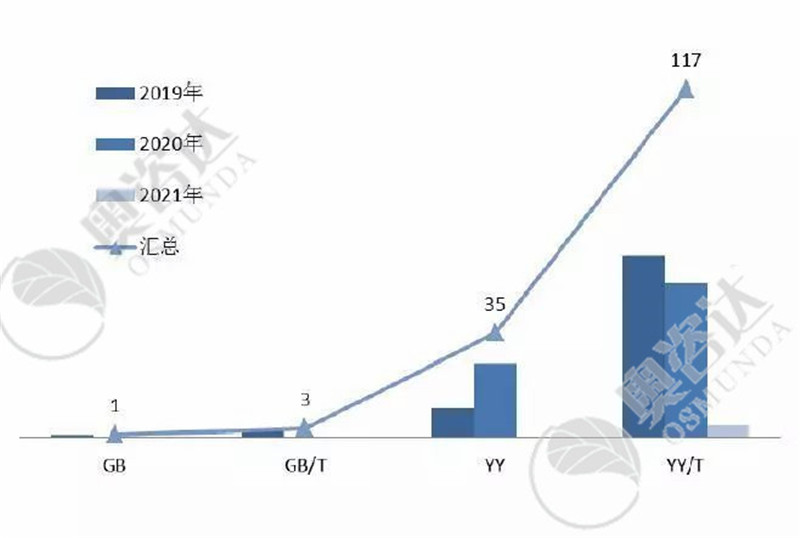
图3 2019-2021年实施的标准数量
来源:NMPA官网,奥咨达整理。
3
注册审批
审批情况
2019年7月,国家局共审批注册证622张。主要情况如下:
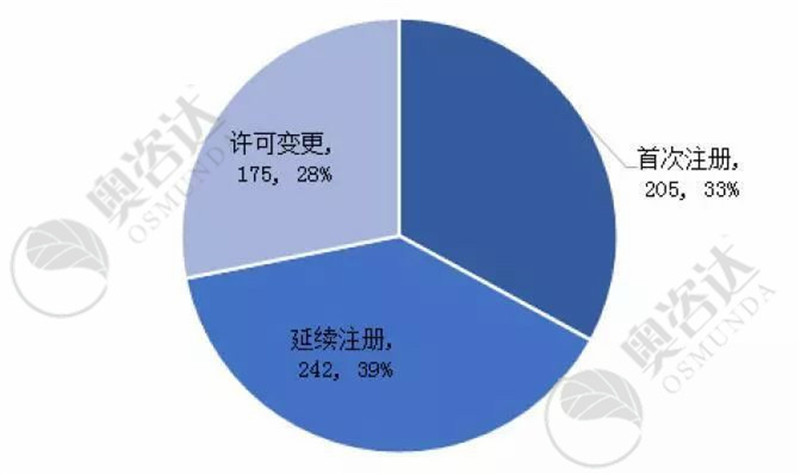
图4 2019年7月注册证的注册类型
来源:CMDE官网,奥咨达整理。
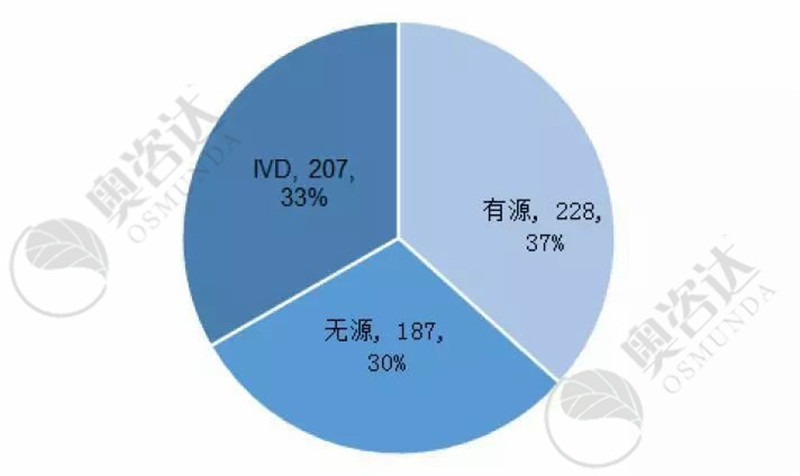
图5 2019年7月注册证的产品种类
来源:CMDE官网,奥咨达整理。
根据国家器审中心的注册批件统计,2019年1~7月国家局共核发4874张注册证。
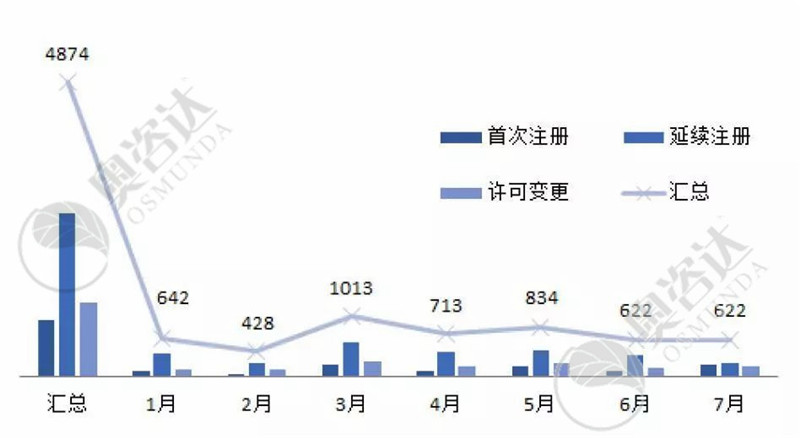
图6 2019年1~7月注册类型
来源:CMDE官网,奥咨达整理。
与2018年同期相比,今年的国家局注册审批数量总体上升,特别是延续注册数量成倍增加。
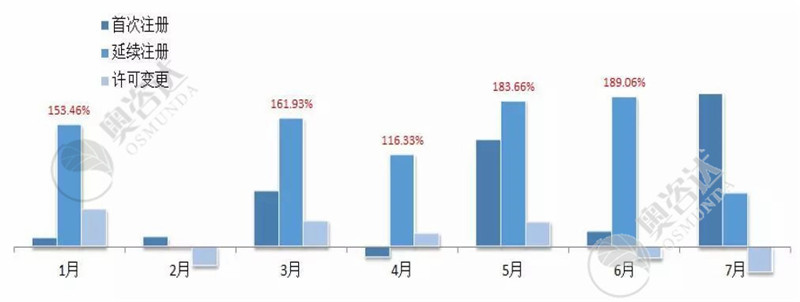
图7 2019年较2018年注册类型同比情况
来源:CMDE官网,奥咨达整理。
根据国家局每月发布的注册数据,今年1~6月的国产III类首次注册证数量排在前五位的是江苏省、北京市、广东省、浙江省和上海市。其中,江苏、北京、浙江都以无源产品居多,而广东省则以体外诊断试剂为首。
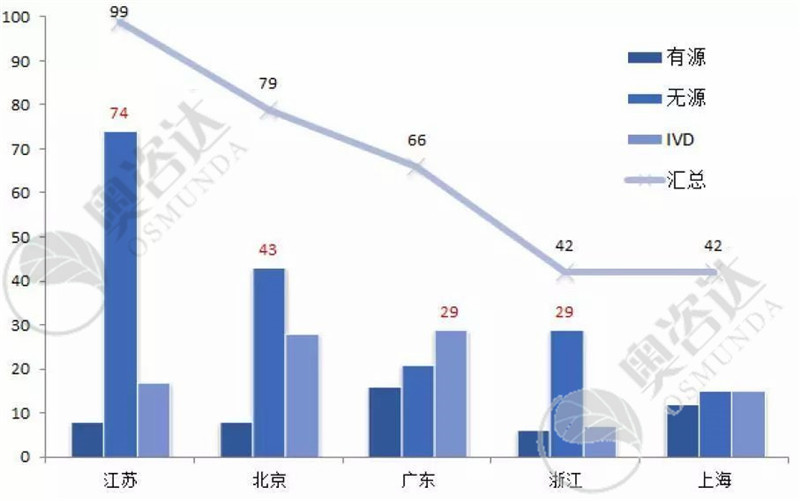
图8 2019年1~6月国产III类首次注册省市分布(前五位)
来源:CMDE官网,奥咨达整理。
4
创新&优先
创新情况
2019年7月,有3个产品进入国家创新通道,分布如下:
表4 2019年7月创新审批产品清单
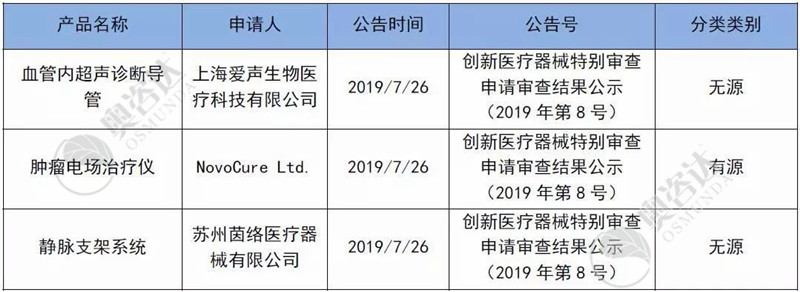
来源:CMDE官网,奥咨达整理。
2019年1~7月创新医疗器械公示数一共为27个,其中有源产品占比约六成。
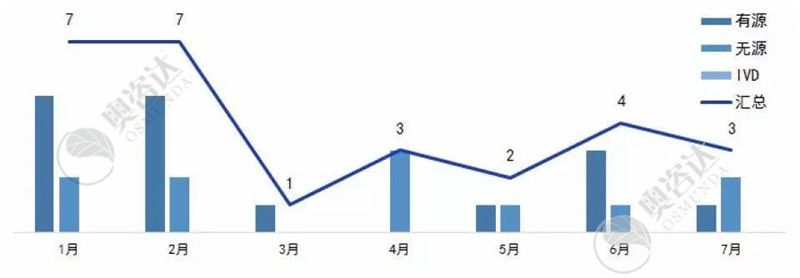
图9 2019年1~7月国家创新公示情况
来源:CMDE官网,奥咨达整理。

图10 2019年1~7月国家创新公示-产品种类
来源:CMDE官网,奥咨达整理。
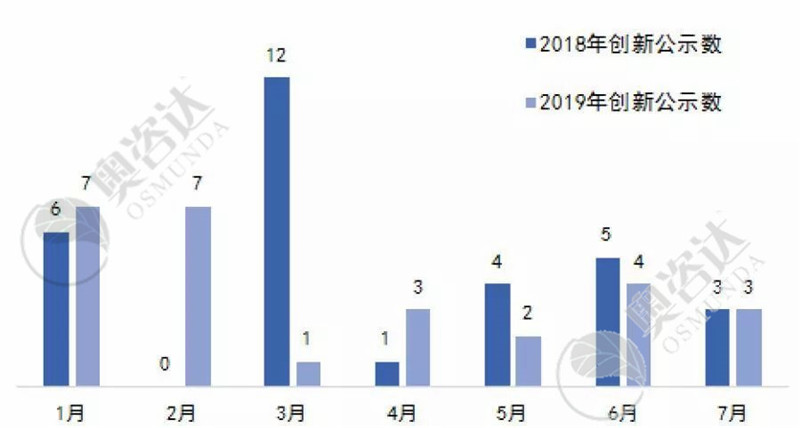
图11 2019年与2018年国家创新审批公示数的对比情况
来源:CMDE官网,奥咨达整理。
2019年1~7月进入创新通道的27个产品中,来自广东省企业的产品数量最多,7个。创新公示数量排名前五的省份如下图:
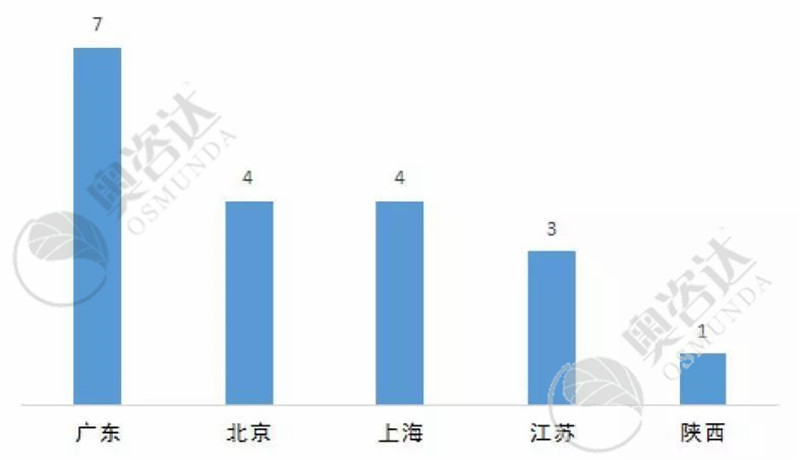
图12 2019年1~7月创新审批各省市数量(前五)
来源:CMDE官网,奥咨达整理。
2014年至今,共232个产品进入国家创新通道、60个创新产品取得医疗器械注册证。而国产产品中,排名前五的省份有北京、广东、上海、江苏、浙江:
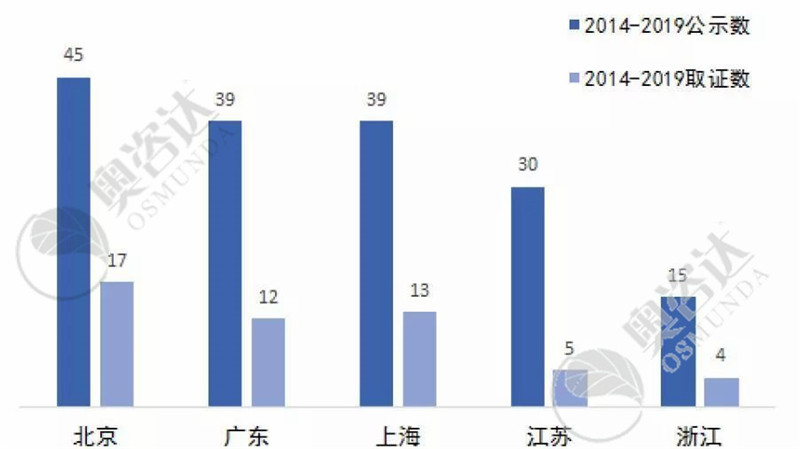
图13 2014年至今创新产品各省市数量分布(前五)
来源:CMDE官网,奥咨达整理。
而在今年的1月~7月,已有多孔钽骨填充材料等5个创新产品取得注册证。创新审批的申请和通过的企业数量逐年上升,绿色通道为国内企业助跑,满足临床迫切需求。
表5 2019年1~7月国家创新产品取证清单
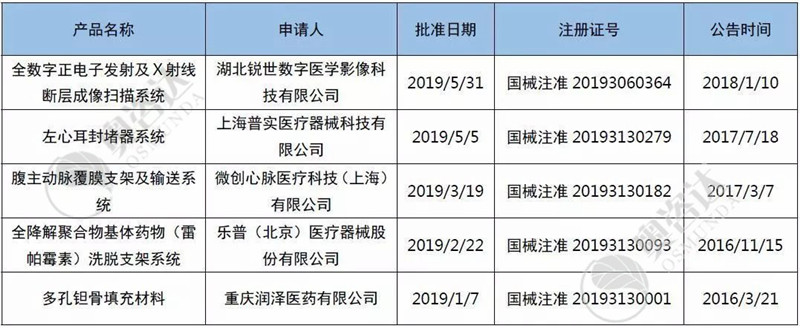
来源:CMDE官网,奥咨达整理。
优先情况
今年1~7月,国家局共批准11个产品进入优先审批通道。具体情况如下:
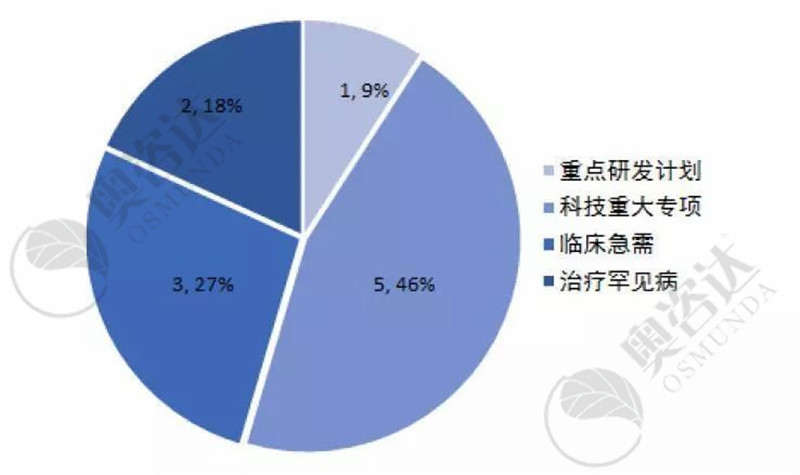
图14 2019年1~7月国家优先审批公示
来源:CMDE官网,奥咨达整理。
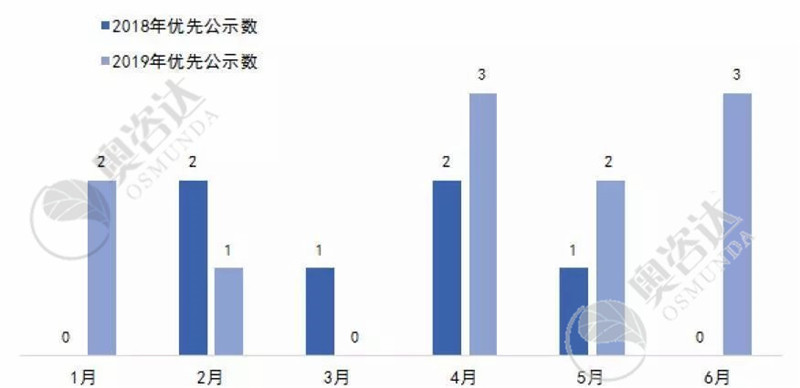
图15 2018与2019年优先审批的公示产品同比
来源:CMDE官网,奥咨达整理。
从图 15可知,2019年同比2018年的优先审批公示数涨幅较大。
2017-2019年共有31个产品进入优先审批通道,如今已有7个产品获批上市。具体产品清单如下:
表6 2017年至今国家优先审批产品取证清单
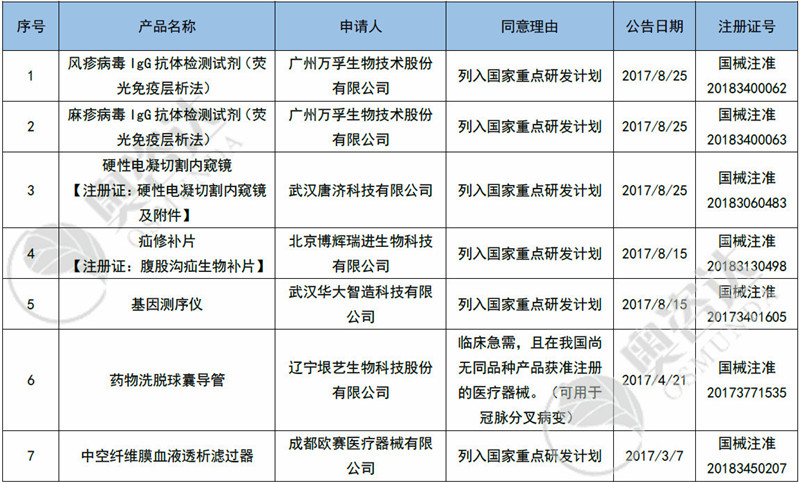
来源:CMDE官网,奥咨达整理。
5
精品分享
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632