OLABS ∨
解决方案 ∨

回顾2018年10月FDA所发布的医疗器械相关新闻,小编认为有以下几个方面需要各方同仁予以关注:
① 产品申报过程中医疗器械网络安全管理相关内容准备的指南(拟稿):该指南中明确说明了含有软件和可编辑程序的医疗器械以及作为医疗器械管理的软件在提交注册申请过程中均需要提交网络安全相关的内容,内容包括设计相关文件及风险管理文档。
② 特殊510(k)计划指南:该计划拟用于简化在已有器械基础上进行更新的器械申请,通过推荐的流程图可自行推断是否适用于该计划。这份指南中提供了多个例子可供参考,为企业申报提供便利。
③ 在确定实质性等同过程中考虑风险获益因素的指南:该指南关注于在FDA审评过程中,发现申报产品与同类产品有着相同的预期用途但在技术特点上存在差异所需要采取的步骤。通过对两个产品在获益、风险以及其他需要关注的因素上的分析,来判定是否能够得出为实质性等同的结论。
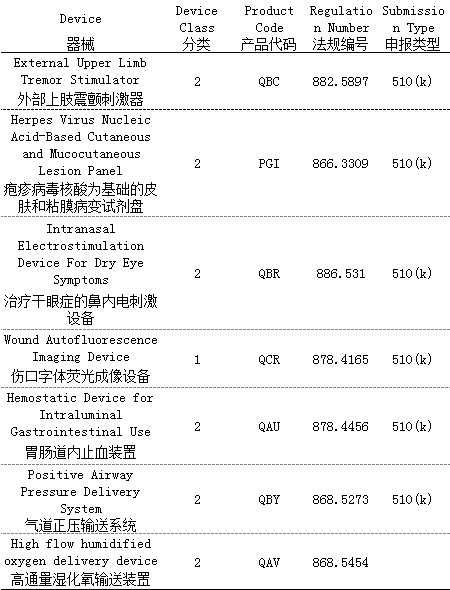
① 特殊510(k)计划试点在线会议
② 510(k)审核计划试点质量评定在线会议

本月发布的指导性文件中,主要涉及到加强医疗器械的网络安全管理以保护患者权益、指导2019财年费用的缴纳、CFG文件申请、认可标准的更新和修订、眼科光学相干断层摄影设备510(k)的简化审查试点计划等方面,对指导企业操作以及完善监督管理有重要意义。
①一级召回:Endologix AFX Endovascular AAA System (AFX),由于存在内漏风险而要求召回
② 一级召回:CyPass® Micro-Stent Systems,由于内皮细胞损失风险而要求召回
最后,小编再唠叨一句,FDA的2019财年已经从2018年10月1日开始计算,不要忘记年度更新哦~~
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632