OLABS ∨
解决方案 ∨

为了更合理高效地配置审评资源,FDA于9月6日推出了510(k) “Quik” Review Program Pilot(快速审评试行程序),该程序可以缩短部分中等风险的产品的审评周期,释放更多资源投入到高风险产品的审评工作中。
该程序可以替代部分产品的传统510(k)申报方式,在申报内容上与传统510(k)要求一致,但在形式上做了创新:
1.使用e-submitter software直接提交申报资料,无需提交纸质文件。
2.审评过程更加灵活,取消第一阶段发补(RTA)程序,改为互动式审评,缩短审评时间。
3.FDA的审评周期由传统510(k)的90天缩短至60天。
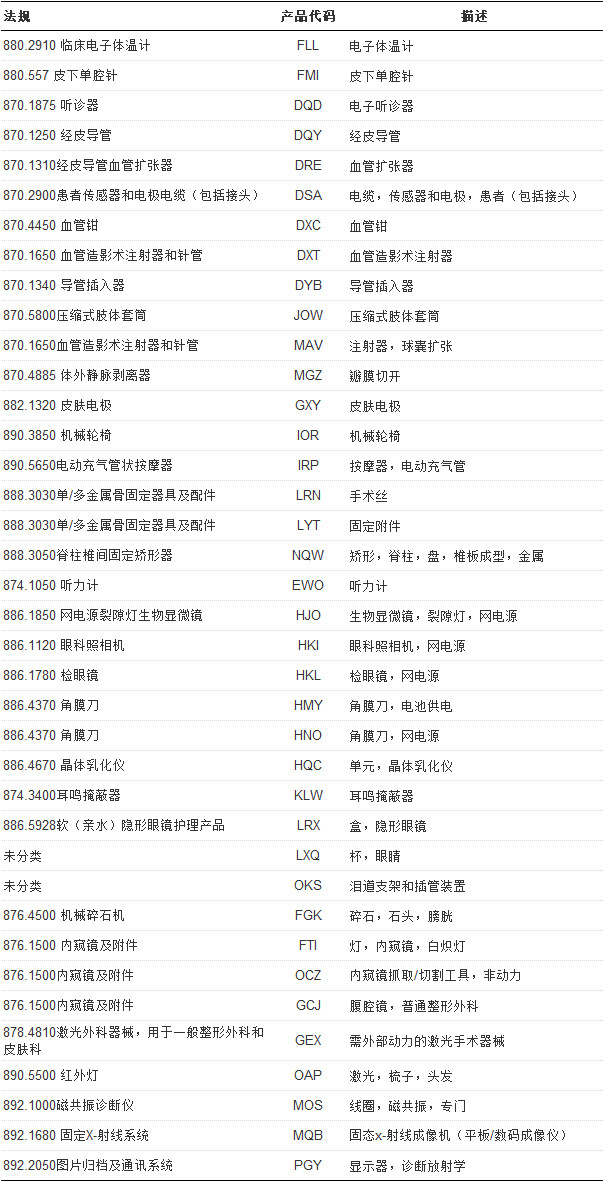
符合该程序的产品应满足如下要求:
1)首要产品代码应在目录内(目录见下表)
2)非组合型产品,如药械组合产品、生物制品-医疗器械组合产品不能通过该程序提交
3)主审评部门需为设备和放射卫生中心(CDRH)
4)提交文件使用eSubmitter“非体外诊断设备-510(k)”模板构建
附:符合“QuikReview Program Pilot”的产品代码清单
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632