OLABS ∨
解决方案 ∨
法规条文也有误?解读需谨慎,看翻译版本的法规,更需谨慎啊!
业界的朋友们都知道,欧盟新MDR 和IVDR法规发布已经一年多了,法规强制实施的日子也开始逼近,而欧盟的公告机构也在陆续出台执行时间表,并开始接受申请预登记——我们的上一篇欧盟法规文稿中提到,已经有公告机构出台政策,对于未能在明年初提交CE申请的,可能不被接受;制造商们也必须开始认真考虑法规的培训和执行问题了。但是,您是否了解,新法规内容有错误?解读需谨慎,看翻译版本的法规,更需谨慎!
奥咨达翻译部在对MDR和IVDR进行中文翻译时,发现了原文中的一些错误,共36处(MDR:9处,IVDR:27处)。对于医疗器械领域的专业翻译而言,要想实现专业准确的语言转化,除扎实的语言功底之外,还需要译者对医疗器械行业各领域的知识积累、对医疗器械行业法规的深刻理解以及严谨认真的翻译态度,法规的翻译更是如此。
奥咨达翻译部已将这些错误进行整理,并与欧盟官方进行了反馈,也获得了欧盟出版局(Publications Office of the European Union)的答复,原文摘录如下:
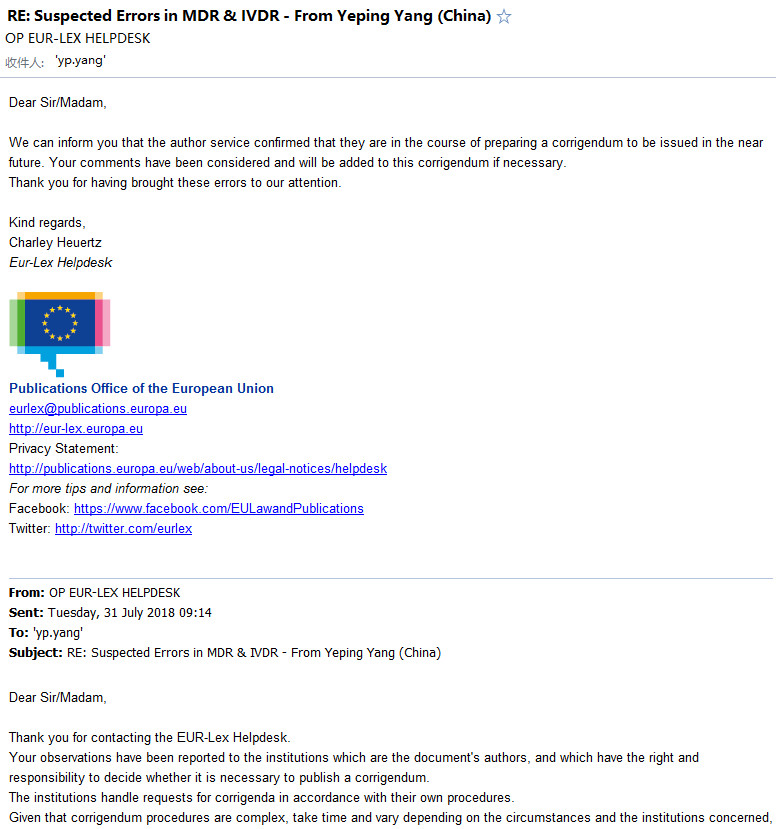
对于欧盟回信中提到的“勘误表”的发布事宜,奥咨达会持续关注,并会及时反馈给业界!
而对于那些会造成原文和译文不一致的原文错误(MDR:4处,IVDR:20处),译者已在译文中加了相应的译者注,方便读者查阅,例如:

奥咨达已将MDR和IVDR翻译成中文,并准备印刷成便携式小册,精心编排成中英对照格式,方便法规从业者和质量人随身携带,随时查阅。精心排版的MDR和IVDR的中英对照版本,连同ISO 13485: 2016、美国FDA QSR 820和中国GMP的中英对照版本一起发行,很快可以与业界朋友们见面,敬请期待。

关于MDR和IVDR的发布背景
2017年5月5日,《欧盟官方公报》(Official Journal of the European Union)正式发布了欧盟医疗器械法规(REGULATION (EU) 2017/745,简称“MDR”)和欧盟体外诊断医疗器械法规(REGULATION (EU) 2017/746,简称“IVDR”)。MDR将取代Directive 90/385/EEC(AIMDD有源植入性医疗器械指令)和 Directive 93/42/EEC(MDD医疗器械指令)。IVDR将取代Directive 98/79/EC(IVDD体外诊断器械指令)。依据MDR第123条的要求,MDR于2017年5月26日生效,并自2020年5月26日起施行。依据IVDR第113条的要求,IVDR于2017年5月26日生效,并自2022年5月26日起施行。
关于奥咨达翻译 专精,所以专业!
致力于成为国际医疗器械领域专业的语言服务供应商!
❖专注于医疗器械、注册申报、法规标准、临床试验和临床医学翻译。
❖我们的译员,十年磨一剑,从英语语言研究, 到医疗器械专业研究,再到医学与法规标准专业语言研究。
❖十多年来,专精只为专业,只为精确地表达语言的精彩。
奥咨达翻译团队的与众不同,源自于奥咨达强大的法规专业知识和综合的医疗器械技术背景,我们的顾问团是长期从事医疗器械全生命周期中各个环节的专业人员;是奥咨达十多年来的法规事务咨询的累积宝库。奥咨达翻译团队依靠专业的译员资源和海量的术语库及记忆库,实现了线上线下资源整合,积累了丰富的专业知识库,为您提供专业的语言服务。
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632