OLABS ∨
解决方案 ∨
关于第二类医疗器械注册申报有关事项的提醒
一、医疗器械注册证有效期内有新的医疗器械强制性标准和/或国家标准品发布实施
如医疗器械注册证有效期内有新的医疗器械强制性标准和/或国家标准品发布实施,已注册产品为符合新的强制性标准和/或国家标准品所做的变化属于应当办理变更注册的,注册人应当提交申请延续注册前已获得原审批部门批准的变更注册(备案)文件及其附件的复印件。
已注册产品为符合新的强制性标准和/或国家标准品所做的变化属于无需办理变更注册手续或者无需变化即可符合新的强制性标准和/或国家标准品的,注册人应当提供情况说明和相关证明资料。
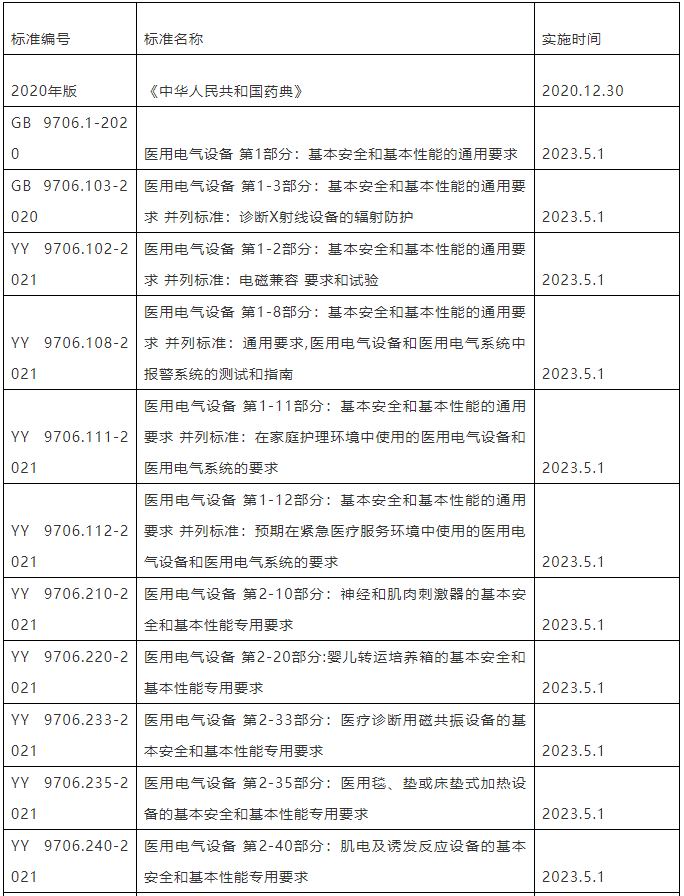
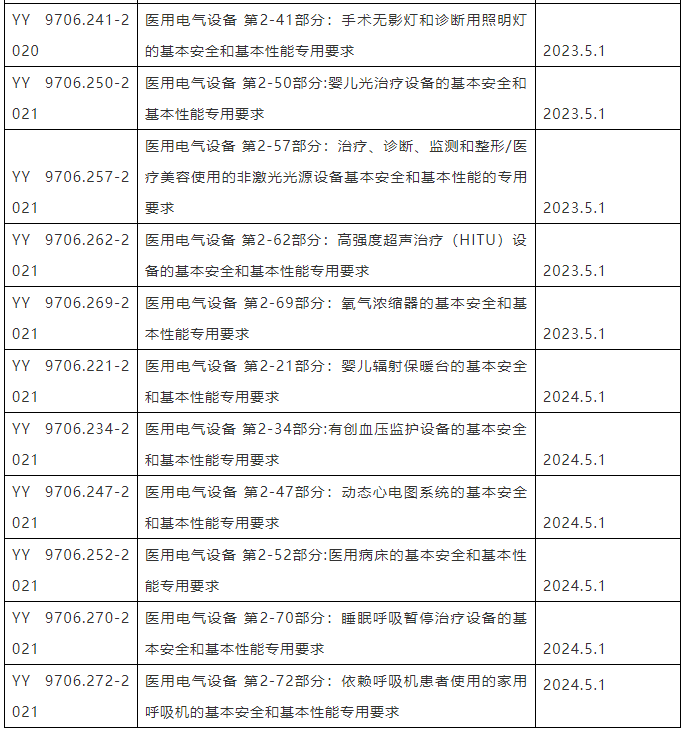
医疗器械强制性标准举例见附件。
二、关于延续注册申请
医疗器械注册证有效期届满需要延续注册的,注册人应当在医疗器械注册证有效期届满6个月前申请延续注册,并按照相关要求提交申请资料。因申请资料不齐全或者不符合法定形式需要补正资料,省局受理中心将在受理补正通知中注明注册人首次申请延续注册时间。注册人补正后再次申请延续注册时,应当提交受理补正通知,省局受理中心将根据受理补正通知中注明的注册人首次申请延续注册时间判定申请延续注册时间是否在医疗器械注册证有效期届满6个月前。
正在办理或即将办理变更注册的,也应当在医疗器械注册证有效期届满6个月前申请延续注册,受理中心将按《办法》中关于延续注册的有关规定办理。
三、关于产品技术要求的编写
医疗器械产品技术要求编写按照《国家药监局关于发布医疗器械产品技术要求编写指导原则的通告(2022年第8号)》要求。
为避免电子证照生成后对医疗器械产品技术要求内容有所遮挡,每页应空两行再进行文字内容的输入。
四、关于质量管理体系建立
注册申请人应当建立与产品相适应的质量管理体系,并保持有效运行。注册申请人应在申请医疗器械注册时提交与产品研制、生产有关的质量管理体系相关资料;注册申报资料受理后即视为申请人已建立质量管理体系,可随时接受现场检查。
五、关于注册检验
申请人注册申请时应递交产品检验报告。产品检验报告应当符合国务院药品监督管理部门的要求,可以是医疗器械注册申请人、备案人的自检报告,也可以是委托有资质的医疗器械检验机构出具的检验报告。委托检验的,注册申请人应当在医疗器械生产质量管理体系文件中对受托方的资质、检验能力符合性等进行评价,并建立合格受托方名录,保存评价记录和评价报告。
有资质的医疗器械检验机构为经国务院认证认可监督管理部门会同国务院药品监督管理部门认定的检验机构。
医疗器械检验机构在符合原国家食药监总局《关于印发医疗器械检验机构资质认定条件的通知》(食药监科〔2015〕249号)的要求和国家药监局《关于明确<医疗器械检验工作规范>标注资质认定标志有关事项的通知》(药监综科外函〔2020〕746号)规定的基础上,出具检验报告。
申请人可在国家认监委网站(http://www.cnca.gov.cn/)“互联网+服务-检验检测-国家级资质认定获证机构”查询检验机构是否具备相应检验能力。
六、关于注册自检
注册申请人注册时开展自检的,申请人应当具备自检能力,并将自检工作纳入医疗器械质量管理体系,配备与产品检验要求相适应的检验设备设施,具有相应质量检验部门或者专职检验人员,严格检验过程控制,确保检验结果真实、准确、完整和可追溯,并对自检报告的真实性依法承担责任。
申报资料应当符合国家药监局《关于发布<医疗器械注册自检管理规定>的公告(2021年第126号)》的要求。
对于提交自检报告的,检查组(由熟悉检验人员参与)开展医疗器械注册质量管理体系现场核查时,除按照有关医疗器械注册质量管理体系核查指南要求办理外,还应当按照2021年第126号“自检能力要求”逐项进行核实,并在现场核查报告中予以阐述。
注册申请人提供的自检报告虚假的,依照《医疗器械监督管理条例》第八十三条规定处罚。受托方出具虚假检验报告的,依照《医疗器械监督管理条例》第九十六条规定处罚。
七、关于延续注册注册证生效日期
延续注册的批准时间在原注册证有效期内的,延续注册的注册证有效期起始日为原注册证到期日次日;批准时间不在原注册证有效期内的,延续注册的注册证有效期起始日为批准延续注册的日期。
八、关于第二类医疗器械(非体外诊断试剂)说明书变更
根据《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)第十六条相关规定,经食品药品监督管理部门注册审查的医疗器械说明书的内容不得擅自更改。
已注册的医疗器械发生注册变更的,申请人应当在取得变更文件后,依据变更文件自行修改说明书和标签。
说明书的其他内容发生变化的,应当向医疗器械注册的审批部门书面告知,并提交说明书更改情况对比说明等相关文件。审批部门自收到书面告知之日起20个工作日内未发出不予同意通知件的,说明书更改生效。
附件:医疗器械强制性标准举例.zip
江苏省药品监督管理局
2022年2月21日
文章来源于江苏药监局,全文由奥咨达整理,了解更多关于医疗器械注册、医疗器械临床等内容,请关注奥咨达网站。
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632