OLABS ∨
解决方案 ∨
国家药监局关于成立全国医疗器械临床评价标准化技术归口单位的公告(2021年第116号)
为贯彻落实《国家药品监督管理局 国家标准化管理委员会关于进一步促进医疗器械标准化工作高质量发展的意见》,进一步完善医疗器械标准化组织体系,国家药监局决定成立全国医疗器械临床评价标准化技术归口单位,现予公布,组成方案见附件。
特此公告。
附件:全国医疗器械临床评价标准化技术归口单位组成方案
国家药监局
2021年9月15日
全国医疗器械临床评价标准化技术归口单位
组成方案
全国医疗器械临床评价标准化技术归口单位主要负责全国医疗器械临床评价专业领域的相关通用标准、专用标准和其他标准制修订工作。包括医疗器械(含按医疗器械管理的体外诊断试剂)临床评价领域基础术语、临床试验质量管理、临床数据管理、临床数据交换、真实世界研究要求、临床数据处理等医疗器械临床评价质量管理和通用要求,不涉及具体产品的临床评价要求。
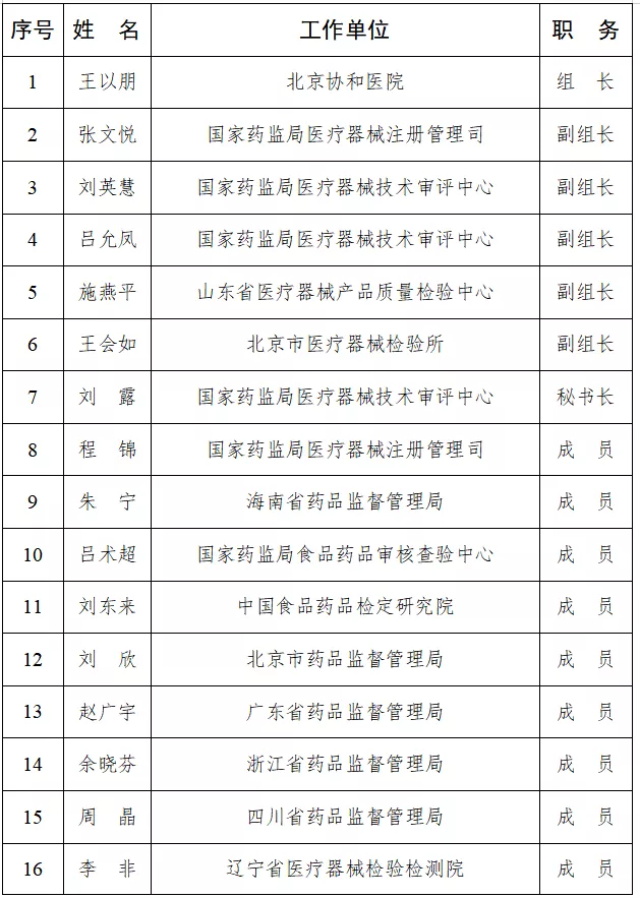
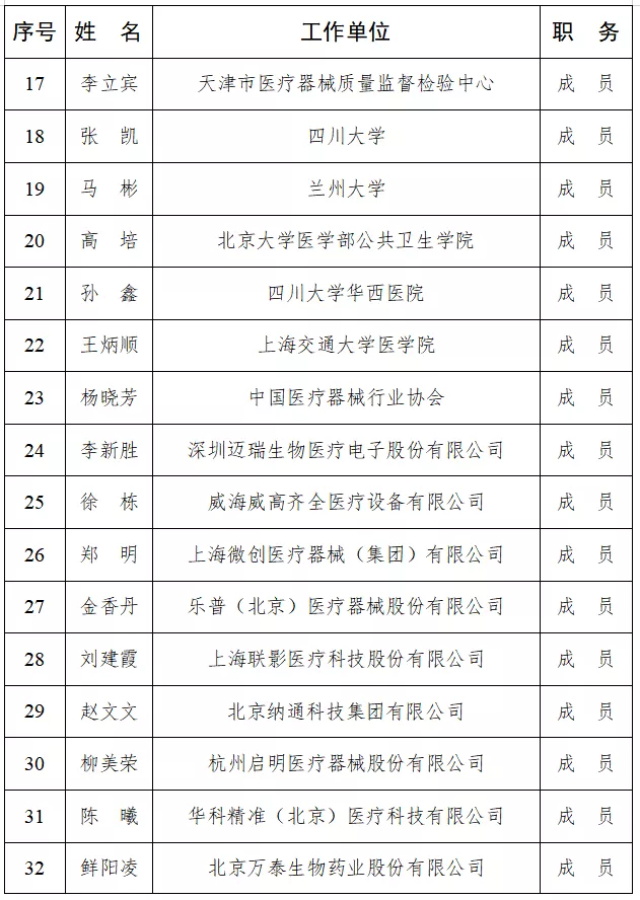
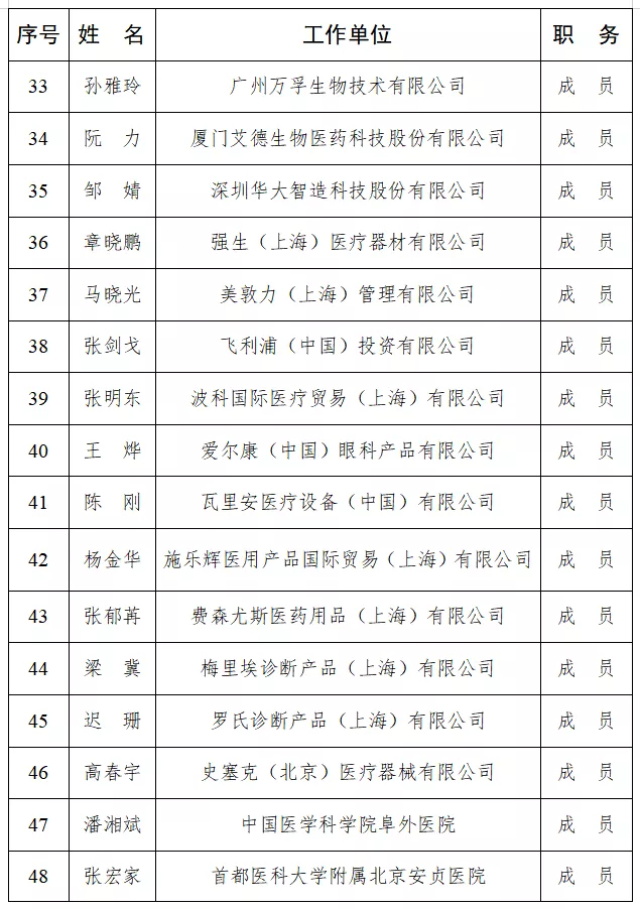
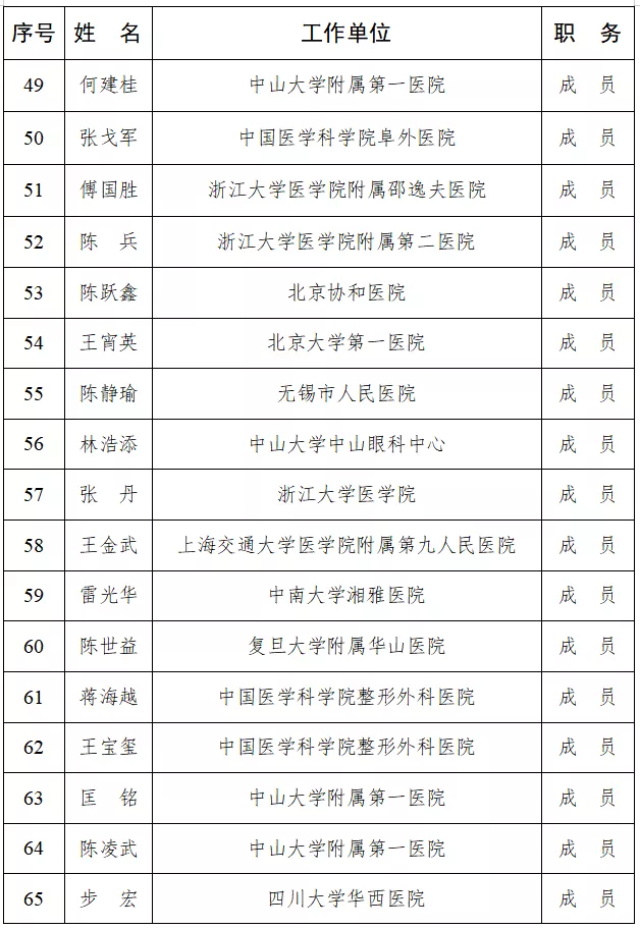
第一届医疗器械临床评价标准化技术归口单位专家组由68名成员组成(名单见下表),秘书处由国家药监局医疗器械技术审评中心承担,由国家药监局医疗器械标准管理中心负责业务指导。
第一届全国医疗器械临床评价标准化技术归口单位
专家组名单

文章来源于国家药监局,全文由奥咨达整理。奥咨达医疗是全球优秀的医疗器械产业服务商,提供医疗器械注册、医疗器械临床、医疗器械委托生产等一站式的医工转化服务,欢迎咨询。
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632