OLABS ∨
解决方案 ∨
国家药监局综合司公开征求《需进行临床试验审批的第三类医疗器械目录(2020年修订版,征求意见稿)》意见
2020年6月24日 发布
为进一步加强医疗器械临床试验的管理,维护医疗器械临床试验过程中受试者权益,推进监管科学研究成果转化,提高审批效率,加快产品上市,国家药品监督管理局组织对需进行临床试验审批的第三类医疗器械目录进行了修订,起草了《需进行临床试验审批的第三类医疗器械目录(2020年修订版,征求意见稿)》(见附件),现向社会公开征求意见。请于2020年7月31日前,将意见或建议以电子邮件方式反馈至ylqxzc@sina.cn,邮件主题请注明“需临床试验审批医疗器械目录反馈意见”。
附件:需进行临床试验审批的第三类医疗器械目录(2020年修订版,征求意见稿)
国家药监局综合司
2020年6月19日
需进行临床试验审批的第三类医疗器械目录(2020年修订,征求意见稿)
与境内外已上市产品相比,采用全新设计、材料或机理,和/或适用于全新适用范围,需要在中国开展临床试验且对人体具有较高风险的医疗器械,为保护临床试验受试者权益,应当进行临床试验审批。包括以下情形:
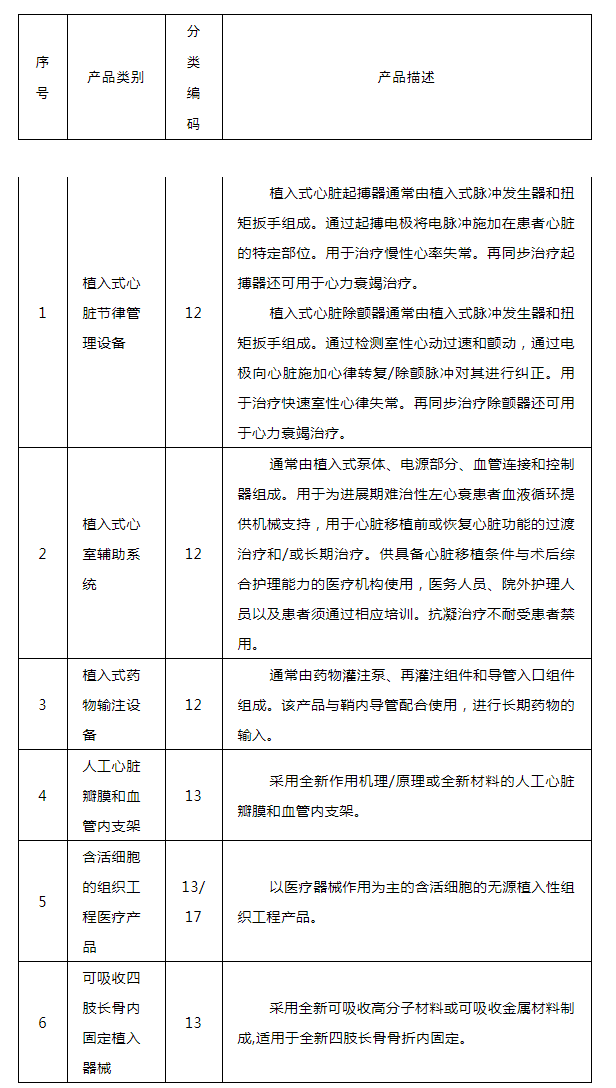
文章内容来源于国家药监局,全球由奥咨达整理。了解更多关于医疗器械临床试验的资讯,请关注奥咨达动态。
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632