OLABS ∨
解决方案 ∨
江苏省局出台医用防护服医用口罩注册和生产许可工作指南
首局行攻许可受理中心、督检查分局、省医疗器械检验所、省局认证审评中心:
根据《医疗器械监督管理条例》《医疗器械注册管理办法》等法规规章要求,结合我省实际,我们制定了《江苏省医用防护服医用口置注册和生产许可办事指南》,经局行政审批专题会议通过。现印发始你们,请各单位认真贯彻执行。
《江苏省医用防护服医用口置注册和生产许可办事指南》全文由省局行政许可受理中心负责在省局官网对外发布。
局行政审批处
2020年6月4日
附件(部分)
江苏省医用防护服医用口罩
注册和生产许可办事指南
本指南依据《医疗器械监督管理条例》、《医疗器械注册管理办法》、《医疗器械生产监督管理办法》、《国家食品药品监督管理总局关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局2014年第43号)、《国家食品药品监督管理总局关于印发境内第二类医疗器械注册审批操作规范的通知》(食药监械管〔2014〕209号)、《国家食品药品监督管理总局关于印发一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点的通知》(食药监械监〔2016〕37号)、《医疗器械生产质量管理规范》及相关附录、检查指导原则、《医用口罩产品注册技术审查指导原则》(国家食品药品监督管理总局 2014年第7号)等文件及相关标准制定。
一、申请人申请
(一)网上申报
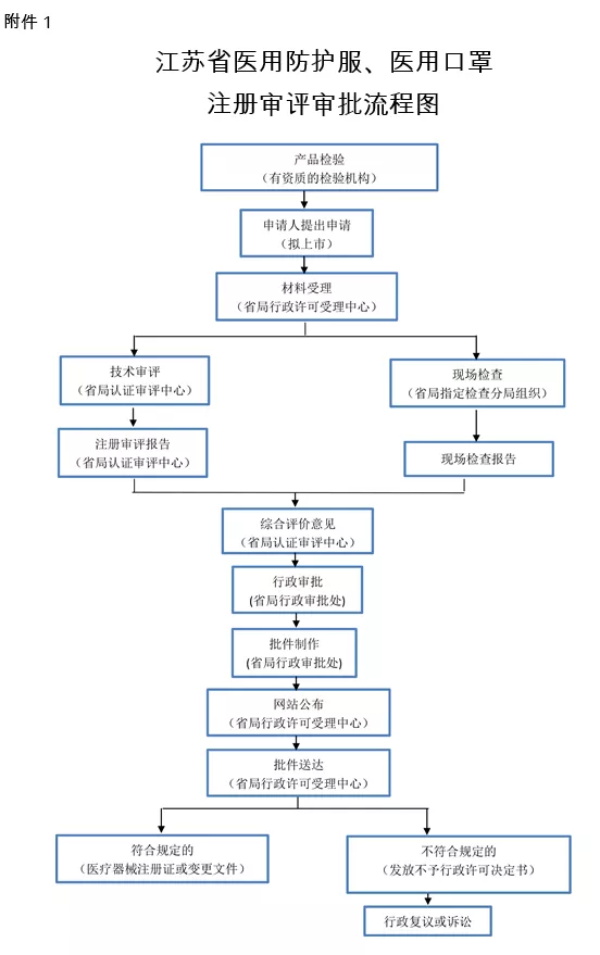
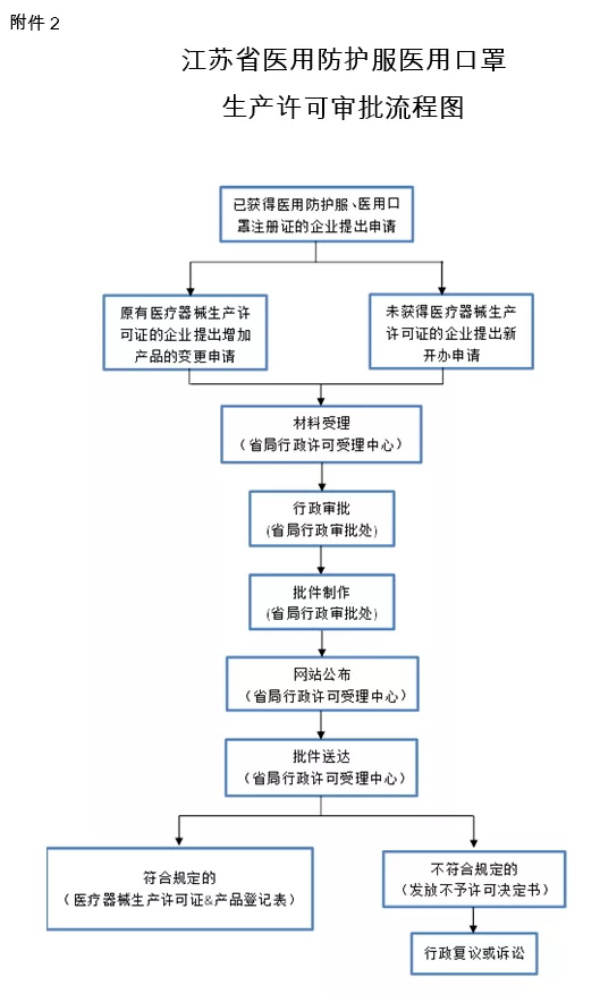
生产医用防护服、医用口罩的企业,应当按照《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)申请第二类医疗器械注册(流程图见附件1),按照《医疗器械生产监督管理办法》(国家食品药品监督管理总局令第7号)申请医疗器械生产许可证(流程图见附件2)。
江苏省医疗器械审批系统已正式上线运行,自2020年5月29日起,申报全部转为线上办理。江苏省医疗器械行政审批系统用户手册见《关于启用江苏省医疗器械行政审批系统的通告》(江苏省药品监督管理局2020年第6号)及省局认证审评中心2020年5月29日发布的《关于江苏省医疗器械审评核查系统上线试运行的通告》。
(二)注册申报要求
申请人按照《医疗器械注册管理办法》《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(国家国家食品药品监督管理总局2014年第43号)要求申请注册,注册申报资料目录见附件3。
申请医用防护服、医用口罩注册,申请人应向国家药监部门认可的有医疗器械检验资质检验检测机构或《市场监管总局公布获国家级资质认定的医疗器械防护用品检验检测机构名录》及获得省级市场监管部门资质认定的防疫用品检验检测机构(在其承检范围内)中的检验机构申请注册检验,并获得符合产品技术要求的全性能检验报告。注册审查时提出补充检验要求的,应在原检验机构进行检验。注册检验样品的生产应符合医疗器械质量管理体系的相关要求。
无菌产品和非无菌产品可按同一注册单元申报,也可分别申报。同一品种同时申报无菌和非无菌的,企业应对无菌产品申请全性能检验,对非无菌产品申请微生物指标补充检测。不同形状的医用防护口罩应分别进行密合性检测。连身式和分身式医用防护服应分别送检。
生物相容性评价研究,应委托具有医疗器械检验资质认定或中国计量认证(CMA)且在其承检范围之内的生物学实验室按照相关标准进行试验。
注册申报有关申请表及申报资料说明详见江苏省药品监督管理局网站-办事指南-第二类医疗器械产品注册审批-第二类医疗器械拟上市产品注册。
(三)生产许可申报要求
申请人取得《医疗器械注册证》后,按照《医疗器械生产监督管理办法》要求申请医用防护服、医用口罩《医疗器械生产许可证》核发或变更,生产许可证核发或变更申报资料目录见附件4。
生产许可核发或变更有关申请表及申报资料说明详见江苏省药品监督管理局网站-办事指南--第二类第三类医疗器械生产许可-开办第二类第三类医疗器械生产企业或医疗器械生产许可证许可事项变更。
二、质量管理体系核查
省局常州检查分局组织质量管理体系核查,按照《医疗器械生产质量管理规范》(国家食品药品监督管理总局2014年第64号)《医疗器械生产质量管理规范附录无菌医疗器械》(国家食品药品监督管理总局2015年第101号)实施,重点检查企业的技术人员配备、设备设施、原材料采购控制、生产过程管理、出厂检验条件和能力、标签标识管理等环节。检查要点见《江苏省医用防护服审批现场检查要点》(附件5)和《江苏省医用口罩审批现场检查要点》(附件6)。
(一)生产环境。无菌医用防护服应确定在十万级洁净区域,非无菌医用防护服应确定在三十万级洁净区域。无菌医用外科口罩、无菌医用防护口罩生产应确定在十万级洁净区域;无菌一次性使用医用口罩、非无菌医用外科口罩、非无菌医用防护口罩生产应确定在三十万级洁净区域;非无菌一次性使用医用口罩生产应确定在受控区域。
(二)原材料控制。企业应具有稳定的原材料供货渠道,提供与原材料供应商签订的购货合同及原材料供应商提供的出厂检测报告等。企业实际生产所用原材料与申报注册送检产品原材料应一致,供应商及原材料型号规格不得随意更换,若发生变化,企业应重新审计供应商且进行相关研究验证工作。
(三)生产管理。企业应具备医用防护服、医用口罩生产的设备设施,除环氧乙烷灭菌可以委托以外,其他工序原则上不得委外。经验证或确认的关键工序和特殊过程的重要参数、设备不得随意更改,若更改应做好有关设计开发变更的验证和确认。每批产品均应有生产记录,并满足可追溯的要求。
依据医用防护服标准GB 19082-2009、一次性使用医用口罩标准YY/T 0969-2013、医用外科口罩标准YY 0469-2011、医用防护口罩标准GB 19083-2010,无菌医用防护服、医用口罩均应采用环氧乙烷灭菌。
(四)成品检验。成品检验应按照每一生产批进行,其中无菌产品的无菌检测和环氧乙烷残留量检测应按照每一灭菌批进行。常规控制的进货检验、过程检验和成品检验项目不得进行委托检验。
三、注册审评审批
省局认证审评中心按照《江苏省医用一次性防护服技术审评要点》(附件7)、《江苏省医用口罩技术审评要点》(附件8),对申请人的注册申报资料进行技术审评,结合质量管理体系核查情况出具综合评价意见。经审评审批符合安全、有效要求的,省局颁发法定效期(5年)的《医疗器械注册证》;不符合安全、有效要求的不予注册。
四、生产许可审批
企业取得《医疗器械注册证》后,一年内申请医用防护服、医用口罩《医疗器械生产许可证》核发或变更的,可提交医用防护服、医用口罩注册质量管理体系核查报告;
一年后申请《医疗器械生产许可证》,或企业生产条件(生产场地、主要质量管理人员、生产环境、生产工艺、生产设备、检验能力等)发生可能影响质量管理体系有效运行等变化的,需重新组织质量管理体系核查。省局对企业许可申报资料进行审核,符合要求的颁发法定效期(5年)的《医疗器械生产许可证》。
持5年效期的医用防护服、医用口罩《医疗器械生产许可证》延续时的现场检查也应符合《江苏省医用防护服审批现场检查要点》和《江苏省医用口罩审批现场检查要点》要求。
附件(部分略):
1.江苏省医用防护服、医用口罩注册审评审批流程图
2.江苏省医用防护服医用口罩生产许可审批流程图
3.江苏省医用防护服、医用口罩注册申报资料目录
4.江苏省医用防护服医用口罩生产许可证核发/变更申报资料目录
5.江苏省医用防护服审批现场检查要点
6.江苏省医用口罩审批现场检查要点
7.江苏省医用一次性防护服技术审评要点
8.江苏省医用口罩技术审评要点
附件摘要:审批流程图
附注摘要:标准目录
医用一次性防护服产品技术要求涉及的标准目录
GB 15979-2002一次性使用卫生用品卫生标准
GB19082-2009医用一次性防护服技术要求GB/T3923.1-2013纺织品织物拉伸性能第1部分:断裂强力和断裂伸长率的测定条样法GB/T4744-2012纺织品防水性能的检测和评价静水压法GB/T4745-2012纺织品防水性能的检测和评价沾水法GB/T5455-2014纺织品燃烧性能垂直方向损毁长度阴燃和续燃时间的测定GB/T12703.1-2008纺织品静电性能的评定第1部分:静电压半衰期GB/T12704.1-2009纺织品织物透湿性试验方法第1部分:吸湿法GB/T 14233.1-2008医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2-2005医用输血、输液、注射器具检测方法第2部分:生物学试验方法YY∕T 1498-2016医用防护服的选用评估指南YY∕T 1499-2016医用防护服的液体阻隔性能和分级《中华人民共和国药典》(2015年版 四部)
一次性使用医用口罩产品技术要求涉及的标准目录
GB15979-2002一次性使用卫生用品卫生标准GB/T14233.1-2008医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2-2005医用输液、输血、注射器具检验方法第2部分:生物学试验方法YY/T0969-2013一次性使用医用口罩FZ/T64005-2011卫生用薄型非织造布《中华人民共和国药典》(2015年版 四部)
医用外科口罩产品技术要求涉及的标准目录
GB15979-2002 一次性使用卫生用品卫生标准GB/T 14233.2-2005 医用输液、输血、注射器具检验方法第2部分:生物试验方法GB/T 14233.1-2008 医用输液、输血、注射器具检验方法第1部分:化学分析方法YY0469-2011 医用外科口罩FZ/T64005-2011 卫生用薄型非织造布《中华人民共和国药典》(2015年版 四部)
医用防护口罩产品技术要求涉及的标准目录
GB15979-2002一次性使用卫生用品卫生标准GB19083-2010医用防护口罩技术要求GB/T 14233.2-2005医用输液、输血、注射器具检验方法第2部分:生物试验方法GB/T 14233.1-2008医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T4745-2012纺织织物表面抗湿性测定沾水试验YY/T0691-2008传染性病原体防护装备医用面罩抗合成血穿透性试验方法FZ/T64034-2014纺粘/熔喷/纺粘(SMS)法非织造布
文章来源于江苏药监局,全文由奥咨达整理发布。奥咨达医疗提供专业的医疗器械注册、医疗器械cdmo、医疗器械CE认证等服务,欢迎咨询了解。
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632