OLABS ∨
解决方案 ∨
关于公开征求《医疗器械软件技术审查指导原则(第二版征求意见稿)》意见的通知
各有关单位:
为进一步规范医疗器械软件注册申报资料要求,并统一审评要求,我中心组织修订了《医疗器械软件技术审查指导原则(第二版征求意见稿)》(附件1),即日起公开征求意见。
如有意见或建议,请填写反馈意见表(附件2)并以电子邮件形式于2020年7月3日前反馈至我中心。
联系人:彭亮
电话:010-86452602
电子邮箱:pengliang@cmde.org.cn
附件:1.医疗器械软件技术审查指导原则(第二版征求意见稿)
2.反馈意见表
国家药品监督管理局医疗器械技术审评中心
2020年6月5日
附件(部分)




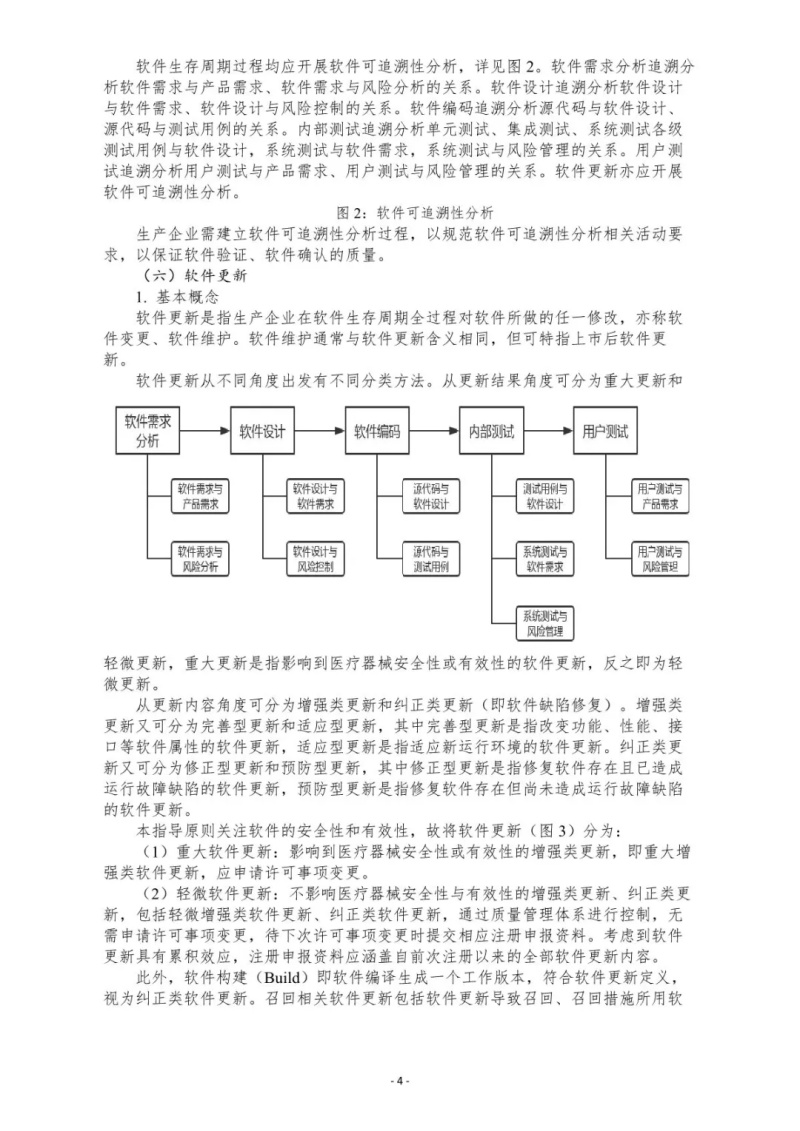
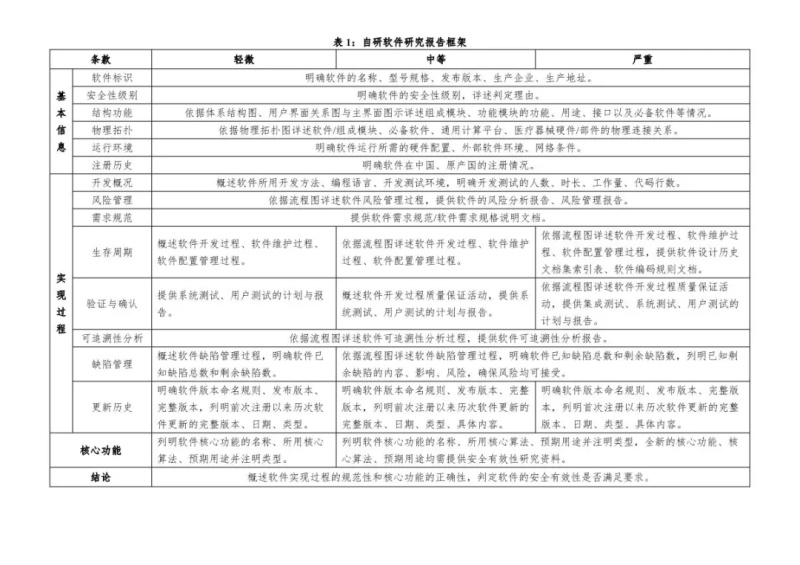



文章来源于国家药监局审评中心,全文由奥咨达整理发布。更多医疗器械政策法规,请关注奥咨达动态。
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632