OLABS ∨
解决方案 ∨
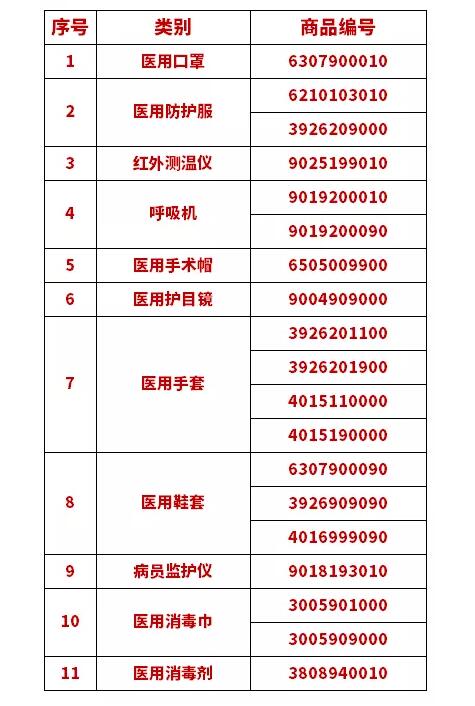
海关总署公告
2020年第53号解读
海关对19个商品编号项下医疗物资实施出口商品检验
为加强医疗物资出囗质呈监管,按照《中华人民共和国进出囗商品检验法》及其实施条例,海关总署决定自4月10日起对19个海关商品编号项下医疗物资实施出囗商品检验。
《中华人民共和国进出口商品检验法》
第五条 列入目录的进出口商品,由商检机构实施检验。前款规定的进口商品未经检验的,不准销售、使用;前款规定的出囗商品未经检验合格的,不准出口。
第十五条 本法规定必须经商检机构检验的出口商品的发货人或者其代理人,应当在商检机构规定的地点和期限内,向商检机构报检。商检机构应当在国家商检部门统一规定的期限内检验完毕,并出具检验证单。
第三十三条 违反本法规定,将必须经商检机构检验的进口商品未报经检验而擅自销售或者使用的,或者将必须经商检机构检验的出囗商品未报经检验合格而擅自出口的,由商检机构没收违法所得,并处货值金额5%以上20%以下的罚款;构成犯罪的,依法追究刑事责任。
第三十五 条进囗或者出口属于掺杂掺假、以假充真、以次充好的商品或者以不合格进出囗商品冒充合格进出囗商品的,由商检机构责令停止进口或者出口,没收违法所得,并处货值金额百分之五十以上三倍以下的罚款;构成犯罪的,依法追究刑事责任。
《中华人民共和国进出口商品检验法实施条例》
第二十四条 法定检验的出口向品的发货人应当在海关总署统一规定的地点和期限内,持合同等必要的凭证和相关批准文件向出入境检验检疫机构报检。法定检验的出口商品未经检验或经检验不合的,不准出口。
出口商品应当在商品的生产地检验。海关总署可以根据便利对外贸易和进出口商品检验工作的需要,指定在其他地点检验。
出口实行验证管理的商品,发货人应当向出入境检验检疫机构申请验证。出入境检验检疫机构按照海关总的规定实施验证。
第四十四条 擅自出囗未报检或青未经检验的属于法定检验的出口商品,或者擅自出口应当申请出口验证而未申请的出囗商品的由出入境检验检疫机构没收违法所得,并处商品货值全额5%以上20%以下罚款;构成犯罪的,依法追究刑事责任。
近期,国外新冠肺炎持续爆发,对口罩等防疫物质需求大增,由于各国标准不同,我国出口非医用口罩误作医用的情况时有发生。3月31日,商务部会同海关总署、药监局发布《关于有序开展医疗物资出口的公告》(2020年第5号),要求出口医用口罩等5类产品必须取得国家药品监管部门相关资质,符合进口国(地区)质量标准要求。
那么,究竟如何快速准确地区分医用与非医用口罩呢?请跟奥咨达医疗一起来了解。
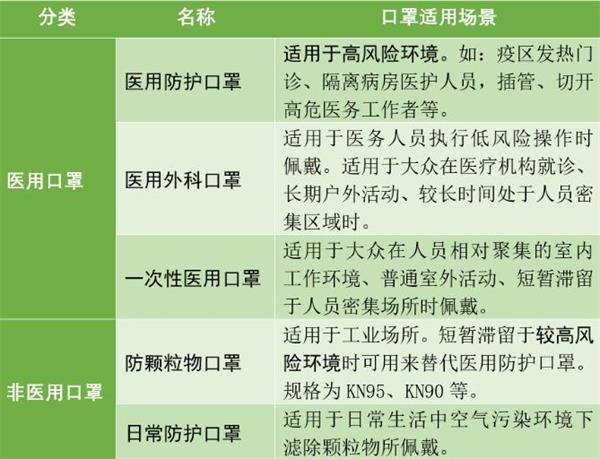
1、口罩的基本分类与细分
口罩从用途可以分为医用/非医用两大类。顾名思义,医用口罩主要用于医疗方面的防护,可以细分为医用防护、医用外科、一次性医用三种;非医用口罩也被称为个人防护口罩,可根据其适用场景,可细分为防颗粒物和日常防护两种。不同用途的口罩其技术要求不同、适用范围也不同。
中国主要的口罩分类
2、利用外观与包装信息区分医用/非医用口罩
通过口罩结构区分
通过过滤阀分辨。带过滤阀的口罩一般不会是医用口罩。如中国医用防护口罩标准GB 19803-2010 第4.3条款就明确规定“口罩不应有呼气阀”,这样可避免飞沫、微生物等通过呼气阀呼出,从而危害他人。而民用口罩允许有呼气阀,通过呼气阀可以减小呼气阻力,从而有利于作业人员长时间工作。

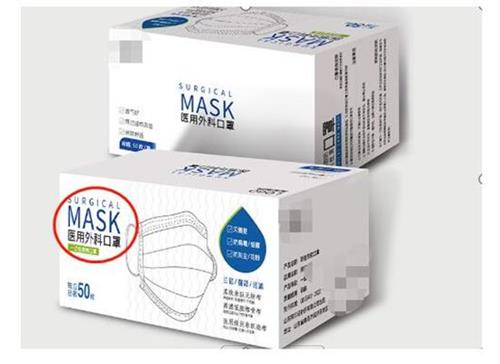
通过外包装上的信息分辨
正规途径销售的口罩产品的最小单元包装上应该有商品名称、执行的标准和防护等级等信息。这些商家明示的信息可以作为一个分辨点,如商品名称中带有“医用”或英文“surgical”“Medical”等字样的,一般可判定为医用口罩。
3、适用标准区分医用/非医用口罩
医用口罩在不同国家/地区适用不同的标准和认证要求,企业和个人可根据产品进口国家/地区,根据产品的适用标准进行区分,产品适用标准和认证信息可从产品外包装或生产者提供的检测报告或证书获得。
出口美国
医用口罩在美国属于医疗器械,适用《医用口罩材料性能标准规范》(ASTM F2100),由美国食品药品监督管理局(FDA)管理,须通过501K注册或近期FDA公布的其它途径,获得工厂注册和医疗器械列名后方可在美国上市。因此,输往美国的口罩外包装或检测报告或证书上有上述内容的,可被判定为医用口罩。
出口美国非医用口罩不属2020年第5号公告范围,但企业应注意,产品需通过NIOSH注册方可在美国上市。

出口欧盟
欧盟医用/非医用口罩均需加贴CE标志,但适用标准不同。
医用口罩在欧盟属于I类器械,分为I类非无菌和无菌两种,需按照欧盟医疗器械指令93/42/EEC(MDD)或欧盟医疗器械条例EU2017/745(MDR)加贴CE标志,对应的标准是EN14683,输往欧盟的口罩外包装或检测报告、证书上有上述内容的,可被判定为医用口罩。

需要注意的是,根据口罩无菌/非无菌状态,欧盟采取不同的合格评定办法,非无菌医用口罩企业只需进行CE自我符合性声明,不需要通过公告机构认证。在准备好相应文件及测试报告等资料后,即可自行完成符合性声明。无菌医用口罩还必须由授权公告机构进行CE认证。
出口欧盟非医用口罩不属于医疗器械,但需符合欧盟个人防护设备条例EU2016/425(PPE)要求,由授权公告机构进行CE认证并颁发证书,对应的标准是EN149。
出口其它国家和地区
输往其它国家和地区口罩产品,可参考其提供的中国标准检测证书与注册备案信息进行判断,中国医用口罩标准有三个,GB 19083-2010、YY 0469-2011、YY/T 0969-2013,使用这三个标准生产的口罩可被判定为医用口罩。
中、美、欧三个国家或地区医用口罩标准

4、通过政府注册管控信息进行区分
由于医用口罩在大部分国家或地区都是按照医疗器械进行注册或管控的,消费者可以进一步通过相关注册管控信息进行分辨。下面以中、美、欧三个国家和地区举例分析。
中国
医用口罩在中国属于二类医疗器械,是由省一级药品监管部门实施注册管理,可以通过医疗器械查询医疗器械准入号进行查询。链接为:
http://www.nmpa.gov.cn/WS04/CL2590/。
美国
已获得美国FDA准入的口罩产品可以通过其官网查询注册证书号进行查询,链接为:
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPMN/pmn.cfm
另外根据FDA最新政策,目前是在满足一定条件的情况下认可中国标准的口罩,其授权企业的链接为:
https://www.fda.gov/media/136663/download。
欧盟
出口欧盟医用口罩可通过获得授权的公告机构进行查询,其中欧盟医疗器械指令93/42/EEC(MDD)授权的公告机构查询地址为:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=13。
欧盟医疗器械条例EU 2017/745(MDR)授权的公告机构查询地址为:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34。
海关总署商检司将不定期更新部分国家或地区防疫物资技术法规和标准,目前已更新至第三版,链接为:
http://sjs.customs.gov.cn/sjs/zcfg56/2951967/index.html
如果你有寻找医疗器械孵化,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632
您想参观OLABS创新工厂,
那就与我们取得联系吧!
您可以填写右边的表格,让我们了解您的服务需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632