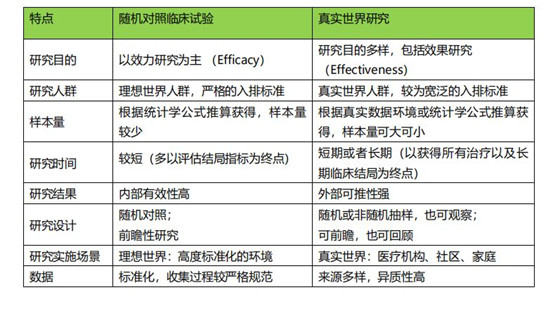
一、注册上市的临床试验RCT能否完全验证高风险产品的安全有效性?一些临床专家和制造商发现,某些高风险医疗器械在通过临床试验注册上市后,在真实运用到患者的治疗过程中,往往出现更多的不确定因素,比如治疗效果的欠缺或者更多的无法预估的不良反应事件,为什么会出现这种现象呢?最早及最著名的真实世界研究(Real World Study, RWS)是由美国马萨诸塞大学医学院于 1999 年发起的急性冠脉事件全球注册研究,这是一项多国参与的、前瞻性的针对所有急性冠脉事件临床处理和患者结局的观察性研究。该研究不考虑患者的入选条件,真实记录了不同地区、不同等级医院在实际工作中对急性冠脉事件的处理方法和处理结果。结果发现,这项真实世界的观察性研究和随机对照的临床试验结果是有差异的,在这些研究中收集的数据的性质和质量变化很大。最后该项研究提出了质疑和假设:是临床试验的RCT结果与真实世界情况的偏差?还是多中心大样本RCT试验结果的准确性本身存在问题?同样的来自另一项前瞻性、观察性的研究是针对加拿大急性冠脉事件Grace登记处的,共有来自 51 个中心的 4627 名患者入组。该项研究评估了来自临床试验的PURSUIT 风险模型和真实世界的GRACE 风险模型,结果同样发现,临床试验的PURSUIT 模型的预后校准较差且次优,这种差异凸显了参加临床试验的患者与“现实世界”患者之间的差异,因此需要在广泛的临床应用之前进行模型验证,才能提供更准确的预后评估。因此,注册上市的临床试验RCT在高风险产品的全生命周期中并不能完全验证其安全有效性。Why? RCT不是目前公认的临床研究方法的金标准吗?其实注册上市的临床试验RCT也有其局限性:如病例数较少;研究时间太短;试验人群的年龄限制;试验条件(纳入、排除)太严格;试验设计限制太多(严格的治疗方式,标准化的护理),因此导致研究结果与真实的临床环境存在差别,注册上市的临床试验RCT并不能提供充足的决策信息。
真实世界研究(Real World Study, RWS)是对临床常规产生的真实世界数据进行系统性收集并进行分析的研究,其研究数据来源于不同类型的数据库。1、现存数据库(Existing database):是基于临床或管理的数据库,如电子病例数据库(Electronic Medical recorddatabases)、医疗保险索赔数据(Medical claims databases)、自动上报系统数据库(Spontaneous reporting systems)、健康调查数据库(Health survey databases)、死亡和出生记录数据库、人口普查数据库。2、前瞻性数据库(Prospective study data)即注册登记数据库(Registry databases)。4、来自移动设备端的数据:应用移动设备,如可穿戴设备,检测受试者获得的相关数据。1、研究基线内容应尽量丰富、完整,在考虑收集主要研究临床适应证和相关基线数据之外,应考虑未来研究拓展的潜在可能性,需尽可能收集丰富完整的数据,这对于在后续统计分析阶段控制混杂因素有重要作用。2、对于长期随访的受试者,应提高受试者依从性,包括充分知情、人文关怀、定期的系统或人工提醒、及采用多种沟通方式,可有效避免受试者失访。3、对于失访和缺失的数据,研究者需要在研究开始时针对缺失数据制定计划,尽可能防止数据缺失,同时为重要研究指标的缺失数据制定计划。4、不同数据库整合的问题,在整合过程中,矛盾的数据和无法整合的数据,需要重点关注,建立统一的数据标准,将不同数据库的数据结构进行标准化处理。5、知情同意和伦理审批的问题,真实世界研究也需要签署知情同意书,但一些回顾性研究是基于既有的数据,不涉及对患者的干预,该类研究可向伦理委员会申请豁免患者知情同意,但其研究方案仍需伦理审查机构审查并得到书面批准。 随着政策层面的上法规监管力度的不断加强和医疗大数据构建给真实世界研究提供便利。包括各级医疗机构、医保部门、医药监管部门积累了大量的医疗数据;各级数据库的电子化及各种电子设备的普及;各级数据库平台的建立,也极大地增加了利用高质量数据进行真实世界研究的可能性。可预见的未来:真实世界研究将成为医保制定、法规监管决策制定及各类高风险产品的临床研究等方面提供重要的依据。1、FDA. Use of Real-World Evidence to Support Regulatory Decision-Making for Medical Devices, Guidance for Industry and Food and Drug Administration Staff,July 27, 2016.2、中国临床医学真实世界研究试行规范,中华实验和临床感染病杂志:2017,12(11).3、真实世界研究指南,http://guide.medlive.cn/4、Louis P. Garrison Jr, et. al, Using Real-World Data for Coverage and Payment Decisions: The ISPOR Real-World DataTask Force Report, 2007,10(5).5、李洪.真实世界研究伦理审查初探,中国循证医学杂志:2018,18(11).1198-1202.
作者:奥咨达医疗器械服务集团 临床研究事业部