2015年06月08日,国家食品药品监管总局发布《关于印发境内第三类医疗器械注册质量管理体系核查工作程序(暂行)的通知》(食药监械管〔2015〕63号),明确了境内第三类医疗器械和体外诊断试剂注册审评过程中质量管理体系核查工作的程序。那么,在质量管理体系核查过程中生产企业应注意哪些事项呢?
1、 范围
仅针对境内第三类医疗器械及体外诊断试剂
境内第二类医疗器械及体外诊断试剂由各省、自治区、直辖市食品药品监督管理部门参照本程序制定,各省的第二类医疗器械注册质量管理体系核查的工作程序将会陆续出台,执行要求肯定会贴近国家局的要求,即将准备申报注册或体系核查的企业应做好充分的准备。
2、 何时进行质量管理体系核查?
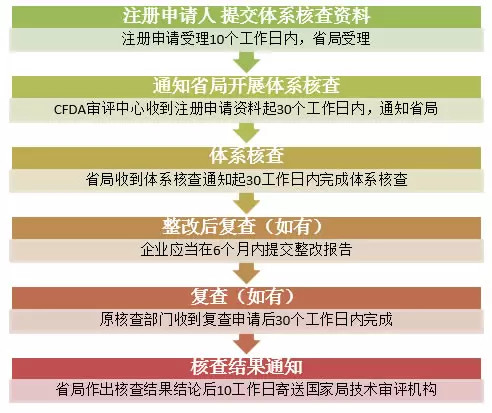
总局技术审评机构自收到境内第三类医疗器械注册申请资料起30个工作日内,通知相应省、自治区、直辖市食品药品监督管理部门开展注册质量管理体系核查。省、自治区、直辖市食品药品监督管理部门应当自收到体系核查通知起30个工作日内完成质量管理体系核查工作。
企业在提交注册申请前应确保公司质量管理体系符合《医疗器械生产质量管理规范》的要求,并进行自查。据了解,部分省市早已规定企业不能推迟申请审核时间,否则需要重新递交申请。
3、 何时提交体系核查资料?
在注册申请受理后10个工作日内向省、自治区、直辖市食品药品监督管理部门提交体系核查资料。
4、 需要提交哪些资料?
1.基本情况表;
2.组织机构图;
3.平面布局图、生产区域布置图;
4.洁净车间环境检测报告(如适用);
5.工艺流程图及控制点说明;
6.主要生产和检验设备目录;
7.质量管理体系自查报告;
8.拟核查产品与既往已通过核查产品在生产条件、生产工艺等方面的对比说明(如适用);
9.部分注册申报资料复印件。
与旧法规相比,体系核查申报资料中包含了部分注册申报资料,主要为与设计开发相关的资料。因此企业在注册申报时进行资料备份,并注意设计历史文档(DHF)中原始记录与注册申报资料保持一致性。
5、 质量管理体系核查的依据是什么?
按照医疗器械生产质量管理规范以及相关附录的要求。
2014年09月05日,国家局发布了《关于医疗器械生产质量管理规范执行有关事宜的通告》,规定自2014年10月1日起,凡新开办医疗器械生产企业、现有医疗器械生产企业增加生产第三类医疗器械、迁移或者增加生产场地的,应当符合《规范》的要求。
目前,无菌医疗器械、植入性医疗器械和体外诊断试剂附录也进入了审批阶段,不久后也将发布。企业应提前做好准备,检查公司现有质量管理体系是否符合新的规定。
6、 核查重点是什么?
在核查过程中,应当同时对企业注册检验样品和临床试验用样品的真实性进行核查。重点查阅设计和开发过程实施策划和控制的相关记录、用于样品生产的采购记录、生产记录、检验记录和留样观察记录等。
企业应加强对产品设计和开发的策划及控制,保证各节点的逻辑性、连贯性和与风险管理措施的关联措施落实情况,特别是新企业,应当注意保留原料采购发票、样品生产、检验等记录。
7、 现场检查时间为多久?
现场检查时间一般为1至3天,如3天仍不能完成检查的可适当延长时间。
8、 审核员包括哪些?
检查组应当由2名以上(含2名)检查员组成,由当地省局指定;企业所在的设区的市级食品药品监督管理部门可派1名观察员参加;必要时,总局技术审评机构参与核查;
必要时,食品药品监督管理部门可邀请有关专家参加现场检查。
增加审评老师和专家参与现场检查的可能性,参与审核技术评审人员可能与注册资料的关注疑难点进行针对性的检查,有利于贯彻质量源于设计的思路。根据以往惯例,普通产品通常为2名审核员,无菌、植入与体外诊断试剂通常为3名审核员。
9、 质量管理体系核查的时限为多久?
注册申请人提交的体系核查资料符合要求的,省、自治区、直辖市食品药品监督管理部门应当自收到体系核查通知起30个工作日内完成。
根据4号令和5号令规定,第三类产品技术审评时间为90个工作日,而在不需要整改的情况下,体系核查时间长为60个工作日,因此体系核查并不会增加注册审评的时限。
10、 检查时发现的问题异议该如何解决?
企业应当提供书面说明。
11、 现场检查的建议结论有哪几种?
建议结论分为三种情况:“通过检查”、“整改后复查”、“未通过检查”。
整改后复查,企业应当在6个月内一次性向原核查部门提交复查申请及整改报告。原核查部门应当在收到复查申请后30个工作日内完成复查。未在规定期限内提交复查申请和整改报告的,以及整改复查后仍达不到“通过核查”要求的,核查结论为“整改后未通过核查”。整改后通过核查的,核查结论为“整改后通过核查”。
需要重视的是,企业只有一次复审的机会。
12、 未通过检查的后果是什么?
如体系核查达不到“通过核查”要求,技术审评机构提出不予注册的审评意见,食品药品监督管理部门作出不予注册的决定。
在此情况下,企业承受的损失极大,意味着前期的产品注册检测、临床试验等工作全部白费,连不菲的注册费用都无法收回。与旧法规相比,企业面临的损失和压力更大。建议各企业在决定注册申报前,应做足准备,进行充分的风险评估,严格遵守相关法律法规要求。
附:境内第三类医疗器械注册质量管理体系核查流程图:
准备好开始了吗?
那就与我们取得联系吧
有一个医疗器械项目想和我们谈谈吗?您可以填写右边的表格,让我们了解您的项目需求,这是一个良好的开始,我们将会尽快与你取得联系。当然也欢迎您给我们写信或是打电话,让我们听到你的声音!
24小时免费咨询热线:
400-6768632